【题目】常温下,向20 mL某浓度的盐酸中逐滴加入0.1 mol/L的氨水,溶液pH的变化与加入氨水的体积关系如图所示。
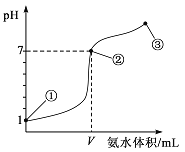
下列叙述正确的是
A. 盐酸的物质的量浓度为l mol/L
B. 在①、②之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-)
C. 在点②所示溶液中:c(NH4+)=c(Cl-)>c(OH-)=c(H+),且V<20
D. 在点③所示溶液中:由水电离出的c(OH-)>l0-7mol/L
参考答案:
【答案】B
【解析】试题分析:A、当未加氨水时,盐酸的pH=1,HCl是强电解质完全电离,氢离子的浓度=HCl的浓度,所以盐酸的物质的量浓度=0.1mol/L,故A错误;B、采用极值法分析,当未加氨水时,溶液中没有铵根离子,所以c(Cl-)>c(NH4+),该溶液呈酸性,即氢离子的浓度大于氢氧根离子的浓度c(H+)>c(OH-),故B正确;C、当溶液的PH=7时,溶液中c(H+)=c(OH-),溶液呈电中性,所以c(Cl-)=c(NH4+);氯化铵是强酸弱碱盐溶液呈酸性,要使溶液呈碱性,氨水的物质的量应该稍微大一些,即V>20,故C错误;D、无论酸溶液还是碱溶液都抑制水的电离,点③所示溶液呈碱性,能抑制水的电离,所以由水电离出的c(OH-)<10-7mol/L,故D错误;故选B。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法正确的是
A. 1molO2的质量是32g/mol B. H2的摩尔质量是2g
C. 1molH+的质量是1g D. 对原子而言,摩尔质量就是相对原子质量
-
科目: 来源: 题型:
查看答案和解析>>【题目】P2O5中P元素的化合价为( )
A.+3
B.+5
C.+4
D.+6 -
科目: 来源: 题型:
查看答案和解析>>【题目】下列所含分子数由多到少的排列顺序是 (用字母排序)
A.标准状况下33.6LH2
B.所含电子的物质的量为4mol的H2
C.20℃时45gH2O
D.常温下,16gO2与14gN2的混合气体
E.含原子总数约为1.204×1024的NH3
-
科目: 来源: 题型:
查看答案和解析>>【题目】聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份。一份溶液中加入足量的BaCl2溶液,得到白色沉淀6.99 g。另一份溶液,先将Fe3+还原为Fe2+,再用0.1600 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液25.00 mL。该聚合硫酸铁样品中a:b的比值为(已知:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O)。
A.1∶1 B.2∶1 C.3∶1 D.2∶5
-
科目: 来源: 题型:
查看答案和解析>>【题目】某有机物A遇FeCl3溶液显紫色,1molA最多能与3molNaOH反应。经测定,A的分子式为C8H8O3并且含有二取代苯结构,则A的结构式的数目为
A. 3 B. 4 C. 5 D. 6
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列气体通入水中,不能形成电解质溶液的是( )
A.NH3
B.O2
C.HBr
D.HCl
相关试题

