【题目】下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,则平衡向正反应方向移动;
CO(g)+H2(g),当增加反应物物质的量时,则平衡向正反应方向移动;
②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率升高;
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率升高;
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体总物质的量增大的方向移动;
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动.
A. ①④ B. ①②③ C. ②③④ D. ①②③④
参考答案:
【答案】D
【解析】试题分析:①C为纯固体,增加C的量,平衡不移动;
②增大N2的浓度,促进氢气的转化,本身的转化率减小;
③反应为气体体积不变时,改变压强,平衡不移动;
④恒压反应器中充入稀有气体,相当于减小压强,平衡可能发生移动.
解:①反应中C为纯固体,增加C的量,平衡不移动,故错误;
②增大N2的浓度,促进氢气的转化,平衡向正反应方向移动,但氮气的转化率减小,故错误;
③若反应前后气体的化学计量数之和相等,则气体体积不变时,改变压强,平衡不移动,故错误;
④恒压反应器中充入稀有气体,相当于减小压强,对反应前后气体的化学计量数之和相等的反应平衡不移动,对反应前后气体的化学计量数之和不等的反应,平衡发生移动,故错误;故选D.
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有机物的分离提纯方法正确的是
A.除去乙酸乙酯中含有的乙酸杂质,可以加氢氧化钠溶液充分振荡后,分液。
B.用重结晶的方法分离苯甲酸和氯化钠的混合物
C.将工业酒精直接蒸馏可以获得无水酒精
D.用酸性高锰酸钾溶液可以除掉甲烷中的乙烯杂质。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下图及描述,回答下列问题:
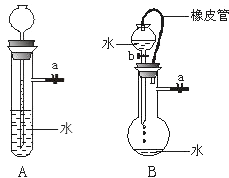
(1)关闭图A装置中的止水夹a后,从长颈漏斗向试管中注入一定量的水,静置后如图所示.试判断:A装置是否漏气?(填“漏气”、“不漏气”或“无法确定”) , 判断理由: .
(2)关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶.试判断:B装置是否漏气?(填“漏气”、“不漏气”或“无法确定”) , 判断理由: . -
科目: 来源: 题型:
查看答案和解析>>【题目】Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下。下列说法不正确的是

A. 石墨电极是该电池的正极
B. 石墨电极上发生还原反应
C. Mg电极的电极反应式:Mg-2e-=Mg2+
D. 电池工作时,电子从Mg电极经导线流向石墨电极,再从石墨电极经电解质溶液流向Mg电极
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关反应热的叙述中正确的是
①已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为△H=-241.8 kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)
 Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大④已知:
共价键
C—C
C===C
C—H
H—H
键能/(kJ·mol-1)
348
610
413
436
上表数据可以计算出
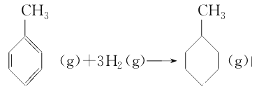 的焓变
的焓变⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2固体时,放出的热量相等
⑥25℃,101 kPa时,1 mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
A.①②③④ B.③④⑤ C.④⑤ D.⑥
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列反应中,属于取代反应的是( )
A.甲烷燃烧B.乙烯与溴的四氯化碳溶液反应
C.乙醇在一定条件下反应生成乙醛D.苯在一定条件下与浓硝酸反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关物质的性质与用途具有对应关系的是( )
A.NaHCO3受热易分解,可用于制胃酸中和剂
B.SiO2熔点高硬度大,可用于制光导纤维
C.Al2O3熔点高,可用作耐高温材料.
D.Na2O能与水反应,可用作食品干燥剂
相关试题

