【题目】相同温度下等物质的量浓度的下列溶液中,pH值最小的是( )
A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
参考答案:
【答案】C
【解析】
试题分析:在四种溶液中都存在盐的水解平衡:NH4++H2O![]() NH3·H2O+H+;水解消耗氢氧根离子,使溶液中氢离子的浓度增大,所以溶液显酸性;在NH4HCO3的溶液中还存在水解平衡:HCO3-+H2O
NH3·H2O+H+;水解消耗氢氧根离子,使溶液中氢离子的浓度增大,所以溶液显酸性;在NH4HCO3的溶液中还存在水解平衡:HCO3-+H2O![]() H2CO3+OH-,由于二者水解的酸碱性相反,水解彼此促进,结果导致溶液的酸性减弱;NH4HSO4是强酸的酸式盐,电离产生H+,对NH4++H2O
H2CO3+OH-,由于二者水解的酸碱性相反,水解彼此促进,结果导致溶液的酸性减弱;NH4HSO4是强酸的酸式盐,电离产生H+,对NH4++H2O![]() NH3·H2O+H+起抑制作用,电离产生氢离子使溶液的酸性增强,大于盐水解的酸性,而(NH4)2SO4会发生电离产生2个NH4+,离子浓度大,水解个数多,溶液的酸性大于NH4Cl,但仍然小于NH4HSO4,故四种溶液中溶液的酸性由强到弱的顺序是NH4HSO4>(NH4)2SO4> NH4Cl>NH4HCO3,因此溶液的pH最小的是NH4HSO4,答案选C。
NH3·H2O+H+起抑制作用,电离产生氢离子使溶液的酸性增强,大于盐水解的酸性,而(NH4)2SO4会发生电离产生2个NH4+,离子浓度大,水解个数多,溶液的酸性大于NH4Cl,但仍然小于NH4HSO4,故四种溶液中溶液的酸性由强到弱的顺序是NH4HSO4>(NH4)2SO4> NH4Cl>NH4HCO3,因此溶液的pH最小的是NH4HSO4,答案选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知还原性SO32->I-。某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32- 、SO42-,且所有离子物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判正确的是
A.肯定不含I- B.肯定含有Na+
C.肯定不含SO42-[来、:肯定含有SO32- D.不能肯定是否含有SO42
-
科目: 来源: 题型:
查看答案和解析>>【题目】常温下,pH=10的X、Y两种碱溶液各1 mL,分别稀释至100 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )

A.X、Y两种碱溶液中溶质的物质的量浓度一定相等
B.稀释后,X溶液的碱性比Y溶液的碱性强
C.分别完全中和X、Y这两种碱溶液时,消耗同
浓度盐酸的体积Vx>Vy
D.若8<a<10,则X、Y都是弱碱
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)K2SO4和Al2(SO4)3混合溶液中c(K+)=0.2mol·L-1,c(SO42-)=0.7mol·L-1。
①写出Al2(SO4)3的电离方程式: 。
②c(Al3+)等于 mol·L-1。
(2)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
①除去Mg2+,需要加入的碱溶液为(从下列选项中选出答案,填字母,下同): ;除去SO42-,需要加入的盐溶液为: ;
A.NaOH B.KOH C.BaCl2 D.Ba(NO3)2
②经过操作①后再加入饱和Na2CO3溶液,直至不再产生沉淀为止。这步操作的目的是:除去 和 。(填写离子符号)
③将经过操作②后的悬浊液过滤,滤液中还有两种杂质。为了除去这两种杂质,最后在滤液中加入的溶液是(填溶质化学式) ;
写出除去这两种杂质发生反应的离子方程式 、 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】用12mol·L-1浓盐酸配制100mL 4.20mol·L-1稀盐酸的实验步骤如下:
①计算所需取用浓盐酸的体积 ②量取一定体积的浓盐酸 ③溶解 ④转移、洗涤 ⑤振荡 ⑥定容 ⑦摇匀 ⑧烧瓶贴标签。完成下列问题:
(1)所需取用的浓盐酸体积是 mL,量取浓盐酸所用的量筒的规格是 (从下列中选用) A.10mL B.25mL C.50mL D.100mL
(2)第⑥步实验的操作是 。
(3)下列情况对所配制的浓盐酸有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓盐酸长时间放置在密封不好的容器中 ;
B.容量瓶用蒸馏水洗涤后残留少量的水 ;
C.量完溶液,洗涤量筒,并将洗涤液转入容量瓶 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去)。下列推断不正确的是( )
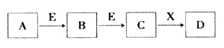
A. 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B. 若D是一种强碱,则A、B、C均可与X反应生成D
C. 若D为NaCl,且A可与C反应生成B,则E可能是CO2
D. 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或 C
-
科目: 来源: 题型:
查看答案和解析>>【题目】对元素周期表和元素周期律的发现有突出贡献的科学家是( )
A.拉瓦锡
B.门捷列夫
C.阿伏加德罗
D.道尔顿
相关试题

