已知向氯酸钠的酸性水溶液中通入二氧化硫气体,反应中SO2氧化过程为:SO2+2H2O –2e- =SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,反应中还原过程为:Cl2 + 2 e- =2Cl-。在上述两个反应中均会生成产物X,则X的化学式为( )
A.ClO2 B.NaClO4 C.HClO D. NaClO
参考答案:
A
【解析】
试题分析:反应1中还原剂SO2 被氧化化合价升高,则NaClO3 中的Cl的化合价(+5)应该降低;反应2中氧化剂是Cl2,被还原化合价降低,所以还原剂亚氯酸钠的Cl的化合价(+3)应该升高,由于两个反应中产生物质均含有X,由此可知生成的X化合物中含有的Cl元素的化合价处在3—5之间,即为+4价,所以满足要求的只有A中的ClO2 ,所以A正确,故选A。
考点:本题考查的是氧化还原反应。
-
科目: 来源: 题型:阅读理解
查看答案和解析>>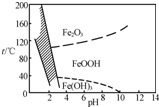 NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如下:
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30min,过滤.
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤.
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬.
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀.
⑤过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性.
⑥向沉淀中加6mol/L的H2SO4溶液,直至恰好完全溶解向沉淀中加6mol/L的H2SO4溶液,直至恰好完全溶解.
⑦蒸发、冷却结晶并从溶液中分离出晶体.
⑧用少量乙醇洗涤并凉干.
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:S2-+2H+═H2S↑S2-+2H+═H2S↑.
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是减少过氧化氢的分解减少过氧化氢的分解.
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH在2~4范围内生成氢氧化铁沉淀;另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去.右图是温度-pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp=2.64×10-39).
下列说法正确的是cdcd(选填序号).
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为6Fe2++Cl
+6H+═6Fe3++Cl-+3H2OO -3
d.工业生产中温度常保持在85℃~95℃生成黄铁矾钢,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是上层清液呈无色上层清液呈无色.
(5)补充上述步骤⑤和⑥(可提供的试剂有6mol/L的H2SO4溶液、蒸馏水、pH试纸). -
科目: 来源: 题型:
查看答案和解析>>(2010•广州二模)(1)大气中SO2含量过高会导致雨水中含有(填化学式)H2SO4、H2SO3H2SO4、H2SO3而危害植物和建筑物.工厂排放的SO2尾气用饱和Na2SO3溶液吸收可得到重要化工原料NaHSO3,反应的化学方程式为SO2+Na2SO3+H2O=2NaHSO3SO2+Na2SO3+H2O=2NaHSO3.
(2)已知NaHSO3的水溶液显酸性,比较其中SO32-、HSO3-、H2SO3三种粒子的浓度:HSO3-HSO3->SO32-SO32->H2SO3H2SO3.
(3)SO2是空气质量报告的指标之一,可用SO2还原KIO3生成I2的反应测定空气中SO2含量.每生成0.01mol I2,参加反应的SO2为0.050.05mol.
(4)已知25℃时:Ksp(BaSO4)=1.1×10-10 Ksp (BaCO3)=2.6×10-9下列说法不正确的是BCBC(填字母).
A.25℃时,向BaSO4悬浊液中加入大量水,Ksp(BaSO4)不变
B.25℃时,向BaSO4悬浊液中加入Na2CO3溶液后,BaSO4不可能转化为BaCO3
C.向Na2SO4中加入过量BaCl2溶液后,溶液中c(SO42-)降低为零
(5)电解法是工业制造氯酸钾的主要方法:电解热的氯化钠水溶液,电解的生成物相互反应制得氯酸钠;再以氯酸钠和氯化钾为原料制备氯酸钾.
①写出电解时的电极反应方程式阴极:2H++2e-=H2↑2H++2e-=H2↑,阳极:2Cl--2e-=Cl2↑2Cl--2e-=Cl2↑.
②电解的生成物相互反应生成氯酸钠的化学方程式为3Cl2+6NaOH=NaClO3+5NaCl+3H2O3Cl2+6NaOH=NaClO3+5NaCl+3H2O. -
科目: 来源:2013-2014学年山东省青岛市高三3月第一次模拟考试(第二套)理综化学试卷(解析版) 题型:填空题
查看答案和解析>>碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl−)制备碱式碳酸铜,其制备过程如下:

已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质
Cu(OH)2
Fe (OH)2
Fe (OH)3
开始沉淀pH
4.2
5.8
1.2
完全沉淀pH
6.7
8.3
3.2
①氯酸钠的作用是 ;
②反应A后调节溶液的pH范围应为 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净? 。
④造成蓝绿色产品中混有CuO杂质的原因是 。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
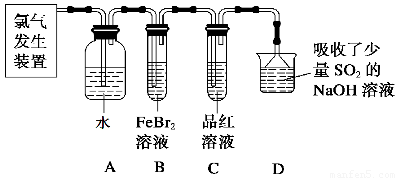
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏的有 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 。此时B装置中发生反应的离子方程式是___________ _____。
③写出A溶液中具有强氧化性微粒的化学式 。若向A溶液中加入NaHCO3粉末,会观察到的现象是 。
-
科目: 来源:2011-2012学年江苏省、大丰高中、栟茶高中高三第二次调研联考化学试卷 题型:填空题
查看答案和解析>>(12分)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30min,过滤。
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤。
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬。
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀。
⑤____________________________________________________。
⑥_____________________________________________________________。
⑦蒸发、冷却结晶并从溶液中分离出晶体。
⑧用少量乙醇洗涤并凉干。
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:_______________________________________。
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是:______________________
_____________________________。
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2~4范围内生成氢氧化铁沉淀;
另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp= 2.64×10−39)。
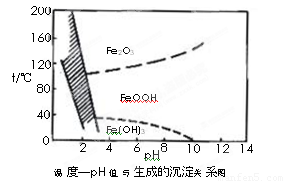
下列说法正确的是______________(选填序号)。
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10−29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是:_____________
_________________________________________________________。
(5)补充上述步骤⑤和⑥【可提供的试剂有6mol/L的H2SO4溶液,蒸馏水、pH试纸】。
-
科目: 来源:2011-2012学年江苏省高三第二次调研联考化学试卷 题型:简答题
查看答案和解析>>(12分)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30min,过滤。
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤。
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬。
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀。
⑤________________________________________________________________________。
⑥_______________________________________________________________________。
⑦蒸发、冷却结晶并从溶液中分离出晶体。
⑧用少量乙醇洗涤并凉干。
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:_______________________________________________。
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是:______________________
_____________________________。
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2~4范围内生成氢氧化铁沉淀;
另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp= 2.64×10−39)。

下列说法正确的是______________(选填序号)。
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10−29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是:_____________
_________________________________________________________。
(5)补充上述步骤⑤和⑥【可提供的试剂有6mol/L的H2SO4溶液,蒸馏水、pH试纸】。
相关试题

