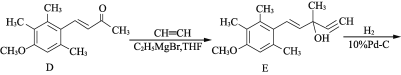
【题目】有机物F是合成药物“银屑灵”的中间体,其合成流程如下:
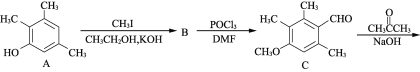
(1) 化合物C中含氧官能团的名称为________、________。
(2) D→E的反应类型为________________,C→D经历了先加成再消去的反应过程,请写出中间产物的结构简式:___________________________。
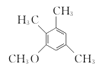
(3) 化合物B的分子式为C10H14O,写出B的结构简式:________________。
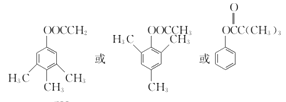
(4) 写出同时满足下列条件的C的一种同分异构体的结构简式:____________________。
①不能发生银镜反应;
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中有4种不同化学环境的氢。
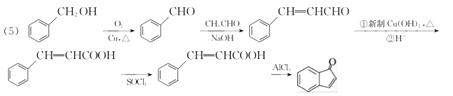
(5) 已知: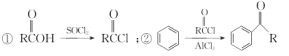 以苯甲醇、乙醛为原料制备
以苯甲醇、乙醛为原料制备![]() ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_________________________ 。
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_________________________ 。
参考答案:
【答案】醛基 醚键 加成反应 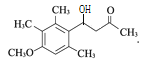
【解析】
(1)C中含有醛基和醚键;
(2)D中碳氧双键打开,与乙炔发生加成反应;
(3)B的结构简式为 ,中间产物的结构简式为:
,中间产物的结构简式为: ;
;
(4)不能发生银镜反应说明不含有醛基也不含有甲酸酯,能发生水解反应说明含有酯基,水解产物之一能与FeCl3溶液发生显色反应,说明是酚酯,且不是甲酸酯,至少为乙酸酯;
(5)流程图中的C与丙酮发生“醛酮缩合”反应生成D。原料中的苯甲醇可以先氧化生成苯甲醛,再与乙醛发生类似于“醛酮缩合”反应,生成![]() ,用新制的Cu(OH)2将醛基氧化为羧基。结合已知①,羧基可以与SOCl2中的氯原子取代生成,再结合已知②,氯原子取代苯环上的氢原子,即可生成目标产物。
,用新制的Cu(OH)2将醛基氧化为羧基。结合已知①,羧基可以与SOCl2中的氯原子取代生成,再结合已知②,氯原子取代苯环上的氢原子,即可生成目标产物。
(1)由C的结构简式可知其中含氧官能团有醛基和醚键,故答案为:醛基、醚键。
(2)由D与E的分子结构的对比可知D→E的反应类型为加成反应,C→D经历了先加成再消去的反应过程,中间产物的结构简式为: ,故答案为:加成反应,
,故答案为:加成反应,
 。
。
(3)由A与B的分子式的对比可知A通过取代反应生成B,B的结构简式为: ,故答案为:
,故答案为: 。
。
(4)不能发生银镜反应说明不含有醛基也不含有甲酸酯,能发生水解反应说明含有酯基,水解产物之一能与FeCl3溶液发生显色反应,说明是酚酯,且不是甲酸酯,至少为乙酸酯,从碳原子数目知,若为乙酸酯,则还多余3个碳原子,依据“对称性”原则,3个碳原子中有2个碳原子对称,另一个甲基与乙酸酯成对位关系,这样分子中的H原子种类有4种,由以上分析其分子结构可能为: ,故答案为:
,故答案为:
 。
。
(5)由题给信息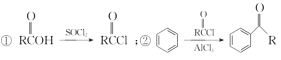 可知,由苯甲醇、乙醛为原料制备
可知,由苯甲醇、乙醛为原料制备![]() 的合成路线流程图为:
的合成路线流程图为:
 ,故答案为:
,故答案为:
 。
。
-
科目: 来源: 题型:
查看答案和解析>>【题目】对可逆反应4NH3(g)+ 5O2(g)
 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质的水溶液因水解而呈酸性的是
A.NH4ClB.Na2CO3C.HClD.NaOH
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关热化学方程式及其叙述正确的是( )
A. 氢气的燃烧热为285.5 kJ·mol-1,则水分解的热化学方程式为:2H2O(l)===2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
B. 已知2C(石墨,s)+O2(g)===2CO(g)ΔH=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1
C. 已知N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后,最多可放出92.4 kJ的热量
2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后,最多可放出92.4 kJ的热量D. 氢气的燃烧热为285.5 kJ·mol-1,则氢气的燃烧热的热化学方程式:H2(g)+1/2O2(g) ===H2O(l) ΔH=-285.5 kJ·mol-1
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列变化过程中,需要吸热的是
A.镁与盐酸反应B.天然气燃烧
C.铁与硫反应D.碘单质升华
-
科目: 来源: 题型:
查看答案和解析>>【题目】一定温度下,在体积为10L的密闭容器中,3molX和1molY进行应:2X(g)+Y(g)
 Z(g),经2min达到平衡,生成0.6molZ,下列说法正确的是
Z(g),经2min达到平衡,生成0.6molZ,下列说法正确的是A. 以X浓度变化表示的反应速率为0.01mol/(L·s)
B. 将容器体积变为20L,Z的平衡浓度为原来的1/2
C. 若增大压强,则物质Y的转化率减小
D. 若升高温度,X的体积分数增大,则该反应的△H<0
-
科目: 来源: 题型:
查看答案和解析>>【题目】过氧化锶(SrO2·2H2O)晶体是一种白色粉末,微溶于水,常用作焰火的引火剂。制备流程如下:
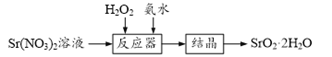
反应原理:Sr(NO3)2+H2O2+2NH3·H2O=SrO2·2H2O↓+2NH4NO3,该反应放热。
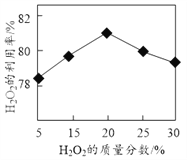
(1)选择不同浓度的双氧水在反应器中反应,测得相同时间H2O2的利用率随浓度的变化关系如图所示。5%的H2O2比20%的H2O2的利用率低的原因是______。
(2)SrO2·2H2O与CO2会反应变质,反应的化学方程式为______。
(3)25℃时,将Sr(NO3)2溶液滴加到含有F-、CO32-的溶液中,当c(Sr2+)=0.0010 mol·L-1时,同时存在SrF2、SrCO3两种沉淀,则此时溶液中c(F-):c(CO32-)=______。[已知25℃时:Ksp(SrF2)=4.0×10-9,Ksp(SrCO3)=5.0×10-9]
(4)准确称取1.8000 g SrO2·2H2O样品置于锥形瓶中,加入适量的盐酸使之充分转化为H2O2,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用1.0000 mol·L-1 Na2S2O3标准液滴定到蓝色恰好消失时,共消耗标准液20.00 mL,计算SrO2·2H2O样品的纯度,写出计算过程________。(已知:S2O32-
 S4O62-)
S4O62-)
相关试题

