
【题目】四氯化锡(SnCl4)常用作有机催化剂、烟雾弹和用来镀锡。某学习小组拟用干燥的氯气和熔融的锡制备 SnCl4 并测定产品的纯度。

已知:i.SnCl4 在空气中极易水解成 SnO2·xH2O;ii.有关物质的物理性质如下表所示。
物质 | 颜色 | 熔点/℃ | 沸点/℃ |
Sn | 银白色 | 232 | 2260 |
SnCl2 | 白色 | 247 | 652 |
SnCl4 | 无色 | -33 | 114 |
回答下列问题:
(1)装置 E 的仪器名称是_____,装置 C 中盛放的试剂是_____。
(2)装置 G 的作用是_____。
(3)实验开始时,正确的操作顺序为_____。
①点燃装置 A 处酒精灯 ②点燃装置 D 处酒精灯 ③打开分液漏斗活塞
(4)得到的产品显黄色是因含有少量_____,可以向其中加入单质___________(填物质名称)而除去。为了进一步分离提纯产品,采取的操作名称是_____。
(5)产品中含少量 SnCl2,测定产品纯度的方法:取 0.400 g 产品溶于足量稀盐酸中,加入淀粉溶液作指示剂,用 0.0100 mo/L 碘酸钾标准溶液滴定至终点,消耗标准液 8.00 mL 。
①滴定原理如下,完成 i 对应的离子方程式。
i._____Sn2++_____IO3-+_____H+= ________Sn4++_____I-+_____
ii.IO3-+5 I2-+6H+ = 3I2 + 3HO
②滴定终点的现象是_____。
③产品的纯度为_____%(保留一位小数)。
【答案】冷凝管 浓硫酸(浓 H2SO4) 吸收多余的 Cl2,防止污染空气;吸收空气中的水蒸气,防止产品水解 ③①② Cl2 锡 蒸馏 3 1 6 3 1 3H2O 锥形瓶内溶液由无色变为蓝色,半分钟不褪色 88.6
【解析】
在A装置中,MnO2与浓盐酸在加热条件下反应生成Cl2,由于浓盐酸易挥发,所以生成的Cl2中混有HCl气体和水蒸气。B装置中,饱和食盐水可除去Cl2中的HCl,C装置用于干燥Cl2,所以应放入浓硫酸;在排尽装置内的空气后,加热D装置,让锡与Cl2反应生成SnCl4蒸汽,冷凝管冷凝后用F装置收集,同时用G装置吸收未反应的Cl2,并防止空气中的水蒸气进入F中,引起SnCl4的水解。
(1)装置 E 的仪器名称是冷凝管,由以上分析知,装置 C 用于干燥氯气,应盛放的试剂是浓硫酸(浓 H2SO4)。答案为:冷凝管;浓硫酸(浓 H2SO4);
(2)装置 G 既可防止氯气进入大气,又可防止大气中的水蒸气进入装置,所以其作用是吸收多余的 Cl2,防止污染空气;吸收空气中的水蒸气,防止产品水解。答案为:吸收多余的 Cl2,防止污染空气;吸收空气中的水蒸气,防止产品水解;
(3)实验开始时,应先加药品再制氯气,最后发生Sn与Cl2的反应,所以正确的操作顺序为③①②。答案为:③①②;
(4)得到的产品显黄色是因含有少量Cl2,可以向其中加入单质锡,让其与Cl2反应生成SnCl4除去。由信息可知,杂质SnCl2的沸点比SnCl4高,可采取的操作名称是蒸馏。答案为:Cl2;锡;蒸馏;
(5)①利用得失电子守恒配平时,可先配含变价元素微粒的化学计量数,再利用电荷守恒、质量守恒配其它物质的化学计量数,从而得到配平的方程式为:3Sn2++IO3-+6H+= 3Sn4++I-+3H2O。答案为:3;1;6;3;1;3H2O;
②滴定终点时,发生反应IO3-+5 I2-+6H+ = 3I2 + 3HO,生成的I2使淀粉变蓝,从而得出产生的现象是锥形瓶内溶液由无色变为蓝色,半分钟不褪色。答案为:锥形瓶内溶液由无色变为蓝色,半分钟不褪色;
③由反应方程式可得关系式:3Sn2+——IO3-,n(Sn2+)=3n(IO3-)=3×0.0100 mo/L×8.00×10-3 L=2.4×10-4mol,产品的纯度为![]() =88.6%。答案为:88.6。
=88.6%。答案为:88.6。


科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是
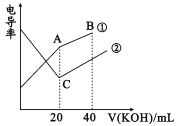
A. B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
B. A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L
C. C点水电离的c(OH-)大于A点水电离的c(OH-)
D. A、B、C三点溶液均有Kw=c(H+)·c(OH-)=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A.冰镇的啤酒打开后泛起泡沫
B.对N2+3H2![]() 2NH3的反应,使用铁触媒可加快合成氨反应的速率
2NH3的反应,使用铁触媒可加快合成氨反应的速率
C.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
D.工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质在水溶液中的电离状况可以进行定量计算和推测。
(1)25℃时两种酸的电离平衡常数如表所示。
Ka1 | Ka2 | |
HA | 1×10-4 | |
H2B | 1×10-2 | 5×10-6 |
①25℃时,0.100mol·L-1的NaA溶液中H+、OH-、Na+、A-、HA的物质的量浓度由大到小的顺序是:___。pH=8的NaA溶液中由水电离出的c(OH-)=___mol·L-1。
②25℃时,0.100mol·L-1的NaHB溶液pH___7,理由是___。
③25℃时,向0.100mol·L-1的Na2B溶液中滴加足量0.100mol·L-1的HA溶液,反应的离子方程式为___。
(2)已知25℃时,向0.100mol·L-1的H3PO4溶液中滴加NaOH溶液,各含磷微粒的物质的量分数随pH变化的关系如图所示。
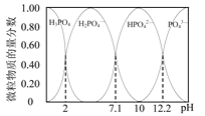
①当溶液pH由11到14时,所发生反应的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】75%的乙醇即医用酒精,因为杀灭病毒效果好且价格相对便宜,在生活中被大量使用。工业上主要用乙烯和水蒸气直接化合法制备乙醇。
回答下列问题:
(1)已知:
①2C2H6(g)+ O2(g)![]() 2C2H4(g)+ 2H2O(g) ΔH1=-192 kJ/mol
2C2H4(g)+ 2H2O(g) ΔH1=-192 kJ/mol
②2H2(g)+ O2(g)![]() 2H2O(g) ΔH2=-484 kJ/mol
2H2O(g) ΔH2=-484 kJ/mol
则③C2H6(g)![]() C2H4(g) + H2(g) ΔH3=__________kJ/mol
C2H4(g) + H2(g) ΔH3=__________kJ/mol
(2)某温度下,一定量的乙烷在刚性容器内发生反应③,起始浓度为 c0,平衡时容器内总压强增加了 20%,乙烷的转化率为_____,该温度下反应的平衡常数 K=__用含 c0 的式子表示)。
(3)气相直接水合法制取乙醇的反应④:H2O(g)+C2H4(g)![]() CH3CH2OH(g) ΔH4。恒压下,当起始 n(H2O)︰n(C2H4)=1︰1 时,催化反应相同时间,测得不同温度下 C2H4 转化为 CH3CH2OH 的转化率如下图所示。(图中虚线表示相同条件下C2H4的平衡转化率随温度的变化)
CH3CH2OH(g) ΔH4。恒压下,当起始 n(H2O)︰n(C2H4)=1︰1 时,催化反应相同时间,测得不同温度下 C2H4 转化为 CH3CH2OH 的转化率如下图所示。(图中虚线表示相同条件下C2H4的平衡转化率随温度的变化)

①分析图像可知ΔH4_____0(填“>”或“<”),理由是_______。
②X 点,v正_________v逆(填“>””“<”或“=”)。在 X 点的条件下,进一步提高 C2H4 转化率的方法是_______(写一种)。
(4)乙醇可用于制备各种燃料电池。下图是乙醇碱性燃料电池的结构示意图,使用的离子交换膜是_____(填“阳离子”或“阴离子”)交换膜,a 侧的电极反应式是_______。
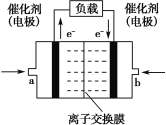
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。制取葡萄糖酸钙的流程如下。
![]()
已知:a.CH2OH(CHOH)4CHO+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr;
b.2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑;
c.相关物质的溶解性见下表:
物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
在水中的溶解性 | 可溶于冷水,易溶于热水 | 可溶 | 易溶 | 易溶 |
在乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
d.酸性:盐酸>葡萄糖酸>碳酸。
请回答下列问题。
(1)制备葡萄糖酸钙涉及的反应类型有__。
(2)第①步中溴水氧化葡萄糖时,下列装置最合适的是__(填序号)。
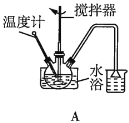
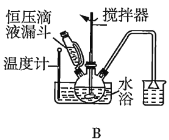
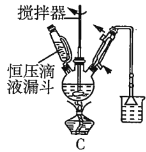
(3)第②步反应CaCO3需过量的原因是__。
(4)本实验中不宜用CaCl2替代CaCO3,理由是__。
(5)第③步需趁热过滤,其原因是__。
(6)若制备时葡萄糖溶液中含有9.0g葡萄糖,步骤⑦后得到8.2g葡萄糖酸钙,则葡萄糖酸钙的产率为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2,5-二羟基苯甲酸甲酯俗称龙胆酸甲酯,可由龙胆酸与甲醇酯化得到,是合成制药中的常见中间体。其结构如右图所示。
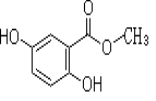
回答以下问题:
(1)龙胆酸甲酯所含官能团名称为 _________________
(2)龙胆酸甲酯的分子式为________________
(3)下列有关龙胆酸甲酯的描述,正确的是______________(填字母)。
a.能发生消去反应
b.能与氢气发生加成反应
c.能与浓溴水反应
(4)龙胆酸甲酯与足量氢氧化钠溶液反应的化学方程式___________________ 。
(5)写出满足下列条件的龙胆酸的两种同分异构体的结构简式_________、____________。
① 能发生银镜反应; ② 能使FeCl3溶液显色;
③ 酯类 ④苯环上的一氯代物只有两种
(6)已知X及其它几种有机物存在如下转化关系,且测得C4H8含有一个支链,A的核磁共振氢谱图中有两个吸收峰。
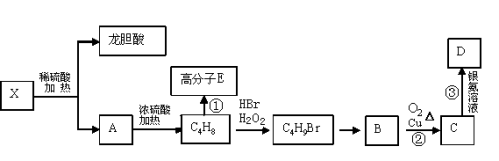
写出①的化学方程式____________________________________。
②的化学方程式______________________________________。
③化学方程式 ________________________________________。
写出X的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种有机物互为同系物,下列有关说法错误的是( )
A.若X为![]() ,则Y不可能是
,则Y不可能是![]()
B.若X是甲醇、Y是乙醇,则Z一定能发生消去反应
C.若X为苯,Y为甲苯,则Z的相对分子质量一定不低于106
D.若X、Y均是饱和一元醛,则Z的分子式一定不是![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com