【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。制取葡萄糖酸钙的流程如下。
![]()
已知:a.CH2OH(CHOH)4CHO+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr;
b.2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑;
c.相关物质的溶解性见下表:
物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
在水中的溶解性 | 可溶于冷水,易溶于热水 | 可溶 | 易溶 | 易溶 |
在乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
d.酸性:盐酸>葡萄糖酸>碳酸。
请回答下列问题。
(1)制备葡萄糖酸钙涉及的反应类型有__。
(2)第①步中溴水氧化葡萄糖时,下列装置最合适的是__(填序号)。
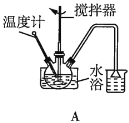
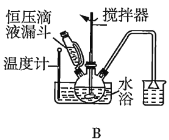
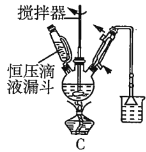
(3)第②步反应CaCO3需过量的原因是__。
(4)本实验中不宜用CaCl2替代CaCO3,理由是__。
(5)第③步需趁热过滤,其原因是__。
(6)若制备时葡萄糖溶液中含有9.0g葡萄糖,步骤⑦后得到8.2g葡萄糖酸钙,则葡萄糖酸钙的产率为__。
【答案】氧化反应、复分解反应 B 提高葡萄糖酸的转化率 氯化钙与葡萄糖酸不能制得葡萄糖酸钙 葡萄糖酸钙冷却后会结晶析出,若不趁热过滤会损失产品 76.3%
【解析】
葡萄糖溶液中加入3%溴水、温度控制在55℃,温度小于100℃,水浴加热,发生的反应CH2OH(CHOH)4CHO+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr,该反应中生成HBr,为防止污染大气,应该用碱液处理HBr;然后向溶液中加入过量CaCO3、温度控制在70℃,发生反应2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑,葡萄糖酸钙可溶于冷水易溶于热水,趁热过滤,将未溶解的碳酸钙除去,然后向滤液中加入乙醇,葡萄糖酸钙微溶于乙醇,所以得到葡萄糖酸钙悬浊液,然后抽滤得到固体,然后洗涤、干燥固体最后得到Ca(C6H11O7)2固体。
(1)CH2OH(CHOH)4CHO与Br2的反应属于氧化反应,葡萄糖酸与CaCO3的反应属于复分解反应;
(2)第①步中反应在55℃时进行,需要水浴加热,且温度计应放置在外部水槽中,A装置中温度计位置放错,C装置直接用酒精灯加热不易控制温度,所以最合适的装置为B;
(3)过量的CaCO3能使葡萄糖酸尽可能转化为葡萄糖酸钙;
(4)因为盐酸的酸性强于葡萄糖酸,氯化钙和葡萄糖酸不能制得葡萄糖酸钙,而H2CO3的酸性比葡萄糖酸弱,CaCO3能与葡萄糖酸发生复分解反应从而得到葡萄糖酸钙;
(5)温度高,葡萄糖酸钙的溶解度较大,趁热过滤,可以减少葡萄糖酸钙的损失;
(6)9.0gC6H12O6(葡萄糖)的物质的量为![]() ,根据化学方程式可知理论上得到葡萄糖酸钙的物质的量为0.025mol,其质量为0.025mol×430g/mol=10.75g,故葡萄糖酸钙的产率为
,根据化学方程式可知理论上得到葡萄糖酸钙的物质的量为0.025mol,其质量为0.025mol×430g/mol=10.75g,故葡萄糖酸钙的产率为![]() 。
。

