
【题目】硫化氢(H2S)是一种无色具有臭鸡蛋气味、能溶于水的高毒性的化合物,其广泛存在化石燃料加工的尾气中。为避免污染环境,可用活性炭材料进行脱硫,脱硫的方法有物理吸附法、化学吸附法和氧化法。
(1)物理吸附法:
物理吸附法是先将尾气缓缓通过活性炭,将H2S从尾气中转移到活性炭的微孔或表面,这是利用活性炭的___性。
(2)氧化法:
利用吸附在活性炭表面上的活性氧(O),将H2S氧化成S而除去,该反应的化学方程式是___。
(3)化学吸附法:
①利用H2S能溶于水,形成硫化氢溶液,更易被活性炭吸附。若0.1molL-1H2S的pH约为4,则H2S在水溶液中的电离方程式是___,被吸附的离子主要有___。
②工业生产中用CuCl2溶液处理活性炭的工艺称为活性炭的改性,改性后的活性炭能提高化学吸附法中H2S的吸收量。
i.用不同浓度的CuCl2溶液改性后的活性炭对H2S吸附量的影响如图所示。随着CuCl2溶液浓度的升高,活性炭对硫化氢吸附量不再增加,原因是过多金属离子阻塞活性炭内部的微孔结构,导致活性炭的吸附能力下降。改性后的活性炭,能提高H2S吸附量的原因是___(用离子方程式表示)。
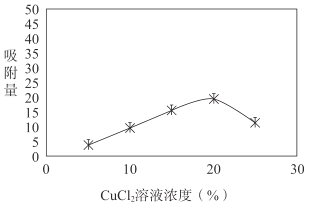
ii.水膜处理对活性炭吸附H2S量也有影响。测定含水量不同时,活性炭对硫化氢吸附量的影响,实验结果如下表。
载水率(%) | 0 | 5.32 | 10.23 | 15.33 | 20.19 |
吸附量(mg/g—活性炭) | 19.62 | 21.52 | 32.42 | 31.28 | 30.78 |
注:载水率即单位质量的活性炭吸附水的质量。
活性炭载水率为10%以上时,吸附量降低,其可能的原因是___。
(4)下列关于活性炭处理H2S尾气的说法正确的是___(选填字母序号)。
a.化学吸附过程中存在着电离平衡的移动
b.活性炭改性时,CuCl2溶液的浓度越大,H2S的吸附量越大
c.其他条件相同时,低温、缓慢通入尾气更有利于H2S的物理吸附
d.适当提高活性炭的载水率,可提高H2S吸附量的原因是活性炭吸附离子比吸附分子能力更强
【答案】吸附 H2S+O=S↓+H2O H2S![]() H++ HS-、HS-
H++ HS-、HS-![]() H++ S2-(第二步电离可以不写) HS-、H+ Cu2++H2S=CuS↓+2H+ 当水分不断增加时,过多的水分子将活性炭表面的微孔结构阻塞,导致活性炭吸附能力下降,吸附量降低 acd
H++ S2-(第二步电离可以不写) HS-、H+ Cu2++H2S=CuS↓+2H+ 当水分不断增加时,过多的水分子将活性炭表面的微孔结构阻塞,导致活性炭吸附能力下降,吸附量降低 acd
【解析】
活性炭有吸附性可以吸附硫化氢气体;活性氧可以和硫化氢发生氧化还原反应;H2S是二元弱酸,在水溶液中分两步电离;活性炭可以脱硫,脱去的是硫离子和硫氢根离子;随着CuCl2溶液浓度的升高,会将硫离子转化为硫化铜沉淀;载水量达到10%以上时,离子的浓度降低,吸附效果变差;活性炭处理H2S尾气时的物理方法和化学方法,从活性炭的吸附能力和硫化氢的变化分析。
(1)物理吸附法是先将尾气缓缓通过活性炭,将H2S从尾气中转移到活性炭的微孔或表面,这是利用活性炭的吸附性;
(2)吸附在活性炭表面上的活性氧(O),会和H2S反应生成S和水,化学反应方程式为:H2S+O=S↓+H2O;
(3)①H2S是二元弱酸,在水溶液中的电离方程式是H2S![]() H++ HS-、HS-
H++ HS-、HS-![]() H++ S2-,0.1molL-1H2S的pH约为4,说明H2S在水溶液的电离程度很低,电离出来的HS-很少,而S2-更少,因此被吸附的主要的离子是HS-以及溶液中的H+;
H++ S2-,0.1molL-1H2S的pH约为4,说明H2S在水溶液的电离程度很低,电离出来的HS-很少,而S2-更少,因此被吸附的主要的离子是HS-以及溶液中的H+;
②改性后的活性炭,能提高H2S吸附量的原因是硫化氢与氯化铜发生反应,离子方程式为:Cu2++H2S=CuS↓+2H+;
活性炭载水率为10%以上时,当水分不断增加时,过多的水分子将活性炭表面的微孔结构阻塞,导致活性炭吸附能力下降,吸附量降低;
(4) a.化学吸附过程中存在着电离平衡的移动,硫化氢在水溶液存在电离平衡,铜离子的加入,促进了硫化氢的电离,故a正确;
b.活性炭改性时,CuCl2溶液的浓度越大,过多金属离子阻塞活性炭内部的微孔结构,导致活性炭的吸附能力下降,H2S的吸附不一定越大,故b错误;
c.其他条件相同时,低温,H2S在水溶液中的溶解度更大,缓慢通入尾气,能让H2S吸附更加完全,因此低温、缓慢通入尾气更有利于H2S的物理吸附,故c正确;
d.根据表格中的数据可知,适当提高活性炭的载水率,可提高H2S吸附量,故d正确;
答案选acd。


科目:高中化学 来源: 题型:
【题目】我国科学家研发的对二甲苯合成流程如图所示。下列说法正确的是( )
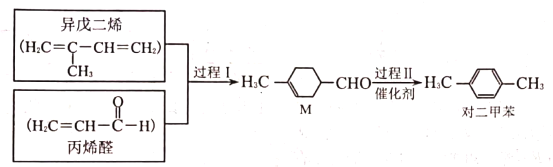
A.过程Ⅰ发生的是取代反应
B.可用溴水鉴别![]() 和对二甲苯
和对二甲苯
C.对二甲苯的密度比水大
D.![]() 的某种同分异构体含有苯环且能与钠反应放出氢气
的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
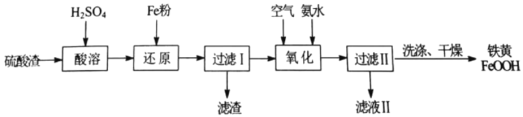
(1)“酸溶”时加快溶解的方法可以是________。(写出一种)
(2)“还原”过程中主要反应的离子方程式为________。
(3)“氧化”过程中,生成FeOOH的离子方程式为________。
(4)“过滤Ⅱ”所得铁黄在洗涤过程中,检验铁黄表面已洗涤干净的操作是________。
(5)实验测得反应溶液的![]() 、温度对铁黄产率的影响如图1、图2所示。
、温度对铁黄产率的影响如图1、图2所示。
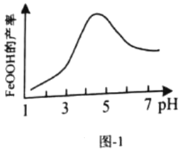
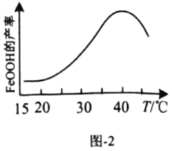
①反应温度宜选择________;
②氧化时应控制pH的合理范围是4.5左右,pH过小或过大均会导致铁黄产率较低,其可能原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语书写正确的是( )
A.金属发生电化学腐蚀的正极反应式:M-ne-=Mn+
B.家用小苏打溶于水后的电离:NaHCO3=Na++H++CO![]()
C.氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O=Fe(OH)3↓+H+
D.用碳酸钠溶液处理锅炉水垢中的硫酸钙:CaSO4(s)+CO![]() (aq)CaCO3(s)+SO
(aq)CaCO3(s)+SO![]() (aq)
(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是( )

A.吸附层b为电池的正极
B.“全氢电池”的总反应为:H++OH-=H2O
C.NaClO4的作用是传导离子并参与电极反应
D.Na+在装置中从左侧透过阳离子交换膜向右侧移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“对氨基苯甲酸丁酯”是防晒霜中能吸收紫外线的防晒剂。下列关于“对氨基苯甲酸丁酯”的说法中正确的是( )
A.它的分子式为C11H15NO2
B.它能与盐酸反应,但不能与苛性钠溶液反应
C.甲酸丁酯基(—COOC4H9)有3种同分异构体
D.从有机物分类看,它可属于氨基酸类、酯类、芳香类
查看答案和解析>>
科目:高中化学 来源: 题型:
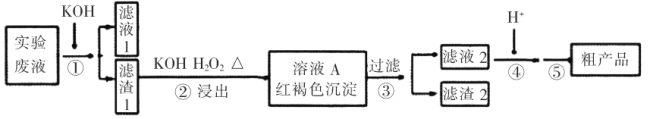
【题目】某实验室废液含![]() 等离子,现通过如下流程变废为宝制备
等离子,现通过如下流程变废为宝制备![]() 。
。
已知:(a)![]()
![]() (黄色)
(黄色)
(b)金属离子形成氢氧化物沉淀的pH范围如表。
金属离子 | pH | |
沉淀 | 沉淀 | |
Fe3+ | 2.7 | 3.7 |
Cr3+ | 4.9 | 6.8 |
请回答:
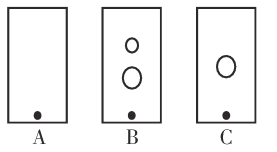
(1)如在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是:_________________。
(2)某同学采用纸层析法判断步骤①加入KOH的量是否合适。在加入一定量KOH溶液后,用毛细管取样、点样、薄层色谱展开、氨熏后的点如图所示。加入KOH最适合的实验编号是(上图ABC中选择,实验顺序已乱)_________________,C的斑点颜色为_________________。
(3)步骤②含Cr物质发生的主要反应的离子方程式为_________________。
(4)在下列装置中,步骤②应选用实验装置是_________________。(填标号)
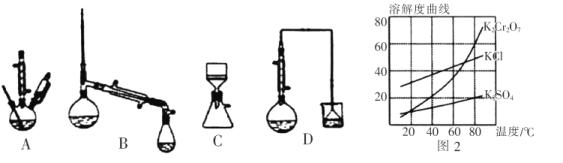
(5)部分物质的溶解度曲线如图2,步骤⑤可能用到下列部分操作:a.蒸发至出现大量晶体,停止加热;b.冷却至室温;c.蒸发至溶液出现晶膜,停止加热;d.洗涤;e.趁热过滤;f.抽滤。请选择合适操作的正确顺序_________________。
(6)步骤⑤中合适的洗涤剂是_________________(“无水乙醇”、“乙醇-水混合液”、“热水”、“冰水”),粗产品进一步提纯的方法是_________________。
(7)取mg粗产品配成250mL溶液,取25.00mL于锥形瓶中,用cmol.L-1的![]() 标准溶液滴定(杂质不反应),消耗标准
标准溶液滴定(杂质不反应),消耗标准![]() 溶液VmL,则该粗产品中
溶液VmL,则该粗产品中![]() 的纯度为_________________。(
的纯度为_________________。(![]() 的式量:294)
的式量:294)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能被视为最具发展潜力的清洁能源,开发新型储氢材料是氢能利用的重要研究方向。请回答下列问题:
Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。
(1)基态B原子的价电子排布式为_____,B、C、N、O第一电离能由大到小的顺序为_____,CH4、NH3、CO2的键角按照由大到小的顺序排列为_____。
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
(1)印度尼赫鲁先进科学研究中心的Datta和Pati等人借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种材料的分子呈平面结构(如图),每个杂环平面上下两侧最多可吸附10个H2分子。
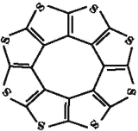
①S的基态原子中能量最高的电子,其原子轨道呈_____形。
②C16S8与H2微粒间的作用力是_____。
③C16S8分子中C原子和S原子的杂化轨道类型分别为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com