【题目】以硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
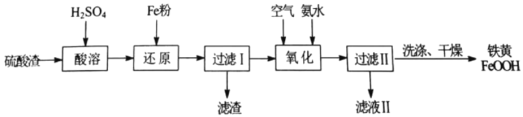
(1)“酸溶”时加快溶解的方法可以是________。(写出一种)
(2)“还原”过程中主要反应的离子方程式为________。
(3)“氧化”过程中,生成FeOOH的离子方程式为________。
(4)“过滤Ⅱ”所得铁黄在洗涤过程中,检验铁黄表面已洗涤干净的操作是________。
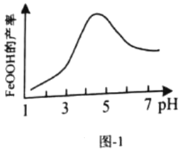
(5)实验测得反应溶液的![]() 、温度对铁黄产率的影响如图1、图2所示。
、温度对铁黄产率的影响如图1、图2所示。
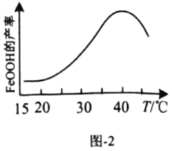
①反应温度宜选择________;
②氧化时应控制pH的合理范围是4.5左右,pH过小或过大均会导致铁黄产率较低,其可能原因是________。
【答案】快速搅拌或适当提高酸溶时温度 Fe+2Fe3+=3Fe2+ ![]() 取最后一次洗涤滤液,滴加盐酸酸化的BaCl2溶液,若无白色沉淀,说明已洗涤干净 40℃ pH过低导致Fe3+不可能完全转为铁黄,pH过大导致部分Fe3+会转化为Fe(OH)3
取最后一次洗涤滤液,滴加盐酸酸化的BaCl2溶液,若无白色沉淀,说明已洗涤干净 40℃ pH过低导致Fe3+不可能完全转为铁黄,pH过大导致部分Fe3+会转化为Fe(OH)3
【解析】
硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)加硫酸溶解,金属氧化物转化为金属阳离子,二氧化硅不溶,再加铁粉把铁离子还原为Fe2+,之后进行过滤,滤渣主要为不溶于稀硫酸的二氧化硅,滤液中含有Fe2+和Al3+,滤液中通入空气氧化,同时加入氨水调节pH生成FeOOH沉淀,过滤、洗涤、烘干,得到纯净的FeOOH;
(1)快速搅拌、适当提高酸溶时温度均可以加快溶解的速率;
(2)还原过程主要为铁粉和铁离子的反应,离子方程式为Fe+2Fe3+=3Fe2+;
(3)根据流程可知氧化过程中氧化剂为O2,Fe2+在碱性环境中被氧化成FeOOH,铁元素化合价升高1价,所以反应中Fe2+和O2的系数比为4:1,再结合元素守恒可得离子方程式为![]() ;
;
(4)根据整个流程可知生成的铁黄表面可能附着硫酸铵,所以需要检验铁黄表面是否存在硫酸根来验证铁黄是否洗涤干净,具体操作为:取最后一次洗涤滤液,滴加盐酸酸化的BaCl2溶液,若无白色沉淀,说明已洗涤干净;
(5)①据图可知温度为40℃时铁黄的产率最高,所以温度选40℃;
②pH过低导致Fe3+不可能完全转为铁黄,pH过大导致部分Fe3+会转化为Fe(OH)3,所以pH过小或过大均会导致铁黄产率较低。

