【题目】I. 处于下列状态的物质中:
①硫酸钡晶体 ②干冰 ③HCl气体 ④铜 ⑤蔗糖 ⑥熔融的硝酸钾 ⑧NaCl溶液 ⑨醋酸
(1)能导电的是(填序号,下同)______________________;
(2)属于弱电解质_______________;
(3)属于非电解质的是___________________________。
II.某消毒液的主要成分为NaClO(混有少量NaCl),请用相应的化学用语来解释下列事实。
(1)该消毒液可用NaOH 溶液吸收Cl2 制备,化学方程式为_______________________;
(2)该消毒液的pH 约为12,离子方程式为_______________________________________;
(3)向FeSO4溶液中滴入少量该消毒液,溶液变成棕黄色,反应的离子方程式为______________________________________;
(4)该消毒液不能与洁厕灵(主要成分为浓盐酸)混用,否则会产生中毒危险。每产生1 mol Cl2(标准状况下),转移电子个数约为__________。
参考答案:
【答案】④⑥⑧⑨②⑤Cl2 + NaOH == NaCl+NaClO+H2OClO-+ H2O ![]() HClO + OH-2Fe2++ClO-+2H+=== Cl-+2Fe3++H2O6.02×1023 或NA
HClO + OH-2Fe2++ClO-+2H+=== Cl-+2Fe3++H2O6.02×1023 或NA
【解析】
I.能导电的物质必须有自由电子或自由移动的离子;电解质是在水溶液里或熔融状态下能导电的化合物;非电解质是在水溶液里或熔融状态下都不能导电的化合物。II.(1)NaOH 溶液吸收Cl2生成氯化钠、次氯酸钠和水;(2)次氯酸钠是强碱弱酸盐,次氯酸钠水解呈碱性;(3)NaClO具有氧化性,向FeSO4溶液中滴入少量该消毒液,Fe2+被氧化为Fe3+;
(4)消毒液与洁厕灵(主要成分为浓盐酸)混用,发生反应NaClO+2HCl=NaCl+Cl2↑+H2O。
I.(1)铜是金属,有自由移动的电子能导电;熔融的硝酸钾和NaCl溶液中有自由移动的离子,所以能导电的是④⑥⑧;(2)醋酸在水中只能部分电离,所以醋酸属于弱电解质,故答案为:⑨;(3)二氧化碳的水溶液能导电,原因是二氧化碳和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子而使溶液导电,碳酸是电解质,二氧化碳是非电解质;蔗糖是在水溶液中或熔融状态下都不能能够导电的化合物,属于非电解质,所以属于非电解质为:②⑤;II.(1)NaOH 溶液吸收Cl2生成氯化钠、次氯酸钠和水,化学方程式是Cl2 + NaOH == NaCl+NaClO+H2O;(2)次氯酸钠水解呈碱性,次氯酸钠水解的离子方程式为ClO-+ H2O ![]() HClO + OH-;(3)NaClO具有氧化性,向FeSO4溶液中滴入少量该消毒液,Fe2+被氧化为Fe3+,反应离子方程式是2Fe2++ClO-+2H+=== Cl-+2Fe3++H2O;(4)消毒液与洁厕灵(主要成分为浓盐酸)混用,发生NaClO+2HCl=NaCl+Cl2↑+H2O,由Cl元素的化合价变化可知,生成1mol氯气转移1mol电子,转移电子个数为6.02×1023或NA。
HClO + OH-;(3)NaClO具有氧化性,向FeSO4溶液中滴入少量该消毒液,Fe2+被氧化为Fe3+,反应离子方程式是2Fe2++ClO-+2H+=== Cl-+2Fe3++H2O;(4)消毒液与洁厕灵(主要成分为浓盐酸)混用,发生NaClO+2HCl=NaCl+Cl2↑+H2O,由Cl元素的化合价变化可知,生成1mol氯气转移1mol电子,转移电子个数为6.02×1023或NA。
-
科目: 来源: 题型:
查看答案和解析>>【题目】1774 年瑞典化学家_____在研究软锰矿(主要成分是 MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味。这种方法至今还是实验室制取的主要方法之一,请写出该反应的化学方程式:__________ 。在实验室,这种黄绿色气体作为尾气通常用_____溶液(填化学式)来吸收, 发生反应的离子方程式是:_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能。
(1)写出基态Mn原子的价电子排布式_____________,基态Mn原子核外电子的运动状态有___种;
(2)①CoTiO3晶体结构模型如图1所示,晶胞参数a=0.53nm。在CoTiO3晶体中1个Ti原子、1个Co原子周围距离最近的O原子数目分别为________个、________个。
②列式表示CoTiO3晶体的密度:________g.cm-3(不必计算出结果,用NA表示阿伏加德罗常数的值)。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO- 互为等电子体的分子、离子化学式分别为___________、___________(各写一种)。
(4)三聚氰胺是一种含氮化合物,其结构简式如图2所示。
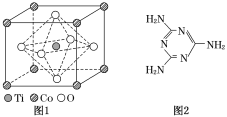
三聚氰胺分子中氮原子轨道杂化类型是____________,1 mol三聚氰胺分子中σ键的数目为________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列反应不属于氧化还原反应的是
A. Zn+2HCl===ZnCl2+H2↑
B. Ca(ClO)2+2HCl===CaCl2+2HClO
C. Pb3O4+8HCl(浓)===3PbCl2+Cl2↑+4H2O
D. 3Cl2+6KOH(浓)
 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O -
科目: 来源: 题型:
查看答案和解析>>【题目】X、Y、 Z三种可溶性盐,其阳离子分别是Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、NO3-中的某一种。现做以下实验:
①将三种盐各取少量,分别溶于盛有5 mL蒸馏水的三支试管中,只有X盐溶液呈蓝色。
②分别向三支试管中加入2 mL稀盐酸,发现Y盐溶液中产生白色沉淀,Z盐溶液无明显现象。
(1)根据上述事实,推断这三种盐的化学式:X______,Y______,Z______。
(2)若上述三种阳离子Ba2+、Cu2+、Ag+对应的盐都为硝酸盐,将其混合配成溶液,选择合适试剂,将这三种离子逐一沉淀分离。其流程图如下:

部分物质溶解性表为
Ba2+
Cu2+
Ag+
Cl-
溶
溶
不
CO32-
不
不
不
SO42-
不
溶
微
S2-
溶
不
不
①沉淀1的化学式为_________________。
②写出混合溶液与试剂A反应的离子方程式:______________。
③若C为Na2S,且它与B的阳离子相同,则试剂B的名称是____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法正确的是( )
A.按系统命名法,化合物
 的名称为2,4﹣二乙基﹣6﹣丙基辛烷
的名称为2,4﹣二乙基﹣6﹣丙基辛烷B. 月桂烯(
 )所有碳原子一定在同一平面上
)所有碳原子一定在同一平面上C. 甲苯能使溴水和KMnO4溶液褪色
D. HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据π键的成键特征判断C==C双键键能是C—C单键键能的 ( )
A.2倍 B.大于2倍
C.小于2倍 D.无法确定
相关试题

