【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A.放电时负极反应为:Zn+2OH--2e-=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3+5OH--3e-=FeO42-+4H2O
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
参考答案:
【答案】C
【解析】
A项、放电时,Zn做负极被氧化生成Zn(OH)2,电极反应式为3Zn-6e-+6OH-═3Zn(OH)2,故A正确;
B项、充电时,Fe(OH)3在阳极发生氧化反应生成FeO42-,电极反应式为Fe(OH)3+5OH--3e-=FeO42-+4H2O,故B正确;
C项、放电时,Fe化合价由+6价降低为+3价,则放电时每转移3mol电子,正极有1molK2FeO4被还原,故C错误;
D项、放电时,K2FeO4为电池的正极,得电子发生还原反应生成Fe(OH)3,电极反应式为2FeO42-+6e-+8H2O═2Fe(OH)3+10OH-,正极生成OH-,溶液碱性增强,故D正确;
故选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法正确的是
A.乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色
B.二氧化氯和三氯化铁都常用于自来水的处理,二者的作用原理相同
C.Ksp不仅与难溶电解质的性质和温度有关,而且还与溶液中的离子浓度有关
D.7.8g过氧化钠含有的共用电子对数为0.1NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图所示装置中,甲池的总反应式为2CH3OH+ 3O2+ 4KOH=2K2CO3+ 6H2O。试回答:
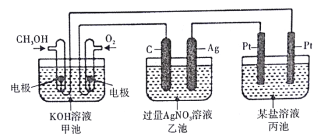
(1)图中甲池的装置是_________(填“原电池”或“电解池”),乙池中石墨电极是________极。
(2)写出通入CH3OH的电极的电极反应式:________________
(3)乙池中总反应的化学方程式为___________________
(4)当乙池中Ag极的质量增加5.40g时,甲池中理论上消耗O2________mL(标准状况);此时丙池某电极上析出1.60g某金属,则丙池中的盐溶液可能是________(填字母)
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
-
科目: 来源: 题型:
查看答案和解析>>【题目】将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
A.c(H+)B.Ka(HF)C.c(F-)/c(H+)D.c(F-)/c(HF)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法正确的是( )
A.NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大
B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
C.在高锰酸钾溶液中,H+、K+、SO42-、葡萄糖分子可以大量共存
D.已知:Ksp(AgCl)=1.8×10-10, Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4的溶解度小于AgCl
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验操作、现象和结论均正确的是( )
选项
实验操作
现象
结论
A
取1mL20%蔗糖溶液,加入适量稀硫酸,水浴加热后取少量溶液,加入几滴新制的Cu(OH)2悬浊液,加热没有砖红色沉淀生成
溶液中未出现砖红沉淀
蔗糖未水解
B
将C和SiO2的固体混合物加热加热
2C+SiO2
 Si+2CO↑
Si+2CO↑非金属性:C>Si
C
向盛有2mL0.1molL-1的NaCl溶液的试管中逐滴加入几滴0.1molL-1AgNO3溶液,充分反应后,再逐滴加入AgNO3溶液,充分反应后,再逐滴加入0.1molL-1的KI溶液
白色沉淀变为黄色沉淀
Ksp(AgCl)>Ksp(Agl),
D
向待测液中加入适量的稀NaOH溶液,将湿润的蓝色石蕊试纸放在试管口
湿润的蓝色石蕊试纸未变红
待测液中不存在NH4+
A.AB.BC.CD.D
-
科目: 来源: 题型:
查看答案和解析>>【题目】某温度下,已知醋酸的电离常数Ka=1.6×10-5,醋酸银的溶度积Ksp(CH3COOAg)=3.7×10-3。下列有关说法正确的是
A. 醋酸溶液中,c(CH3COO-)>c(H+)>c(OH-)
B. 将相同浓度的CH3COOH溶液与CH3COO Na溶液等体积混合,所得溶液呈碱性
C. 该温度下,1mol/L的醋酸溶液中,醋酸的电离度为0.4%
D. 该温度下,浓度均为0.02mol/L的CH3COONa溶液和AgNO3溶液等体积混合(忽略混合后溶液体积的变化),有CH3COOAg沉淀生成
相关试题

