【题目】某温度下,已知醋酸的电离常数Ka=1.6×10-5,醋酸银的溶度积Ksp(CH3COOAg)=3.7×10-3。下列有关说法正确的是
A. 醋酸溶液中,c(CH3COO-)>c(H+)>c(OH-)
B. 将相同浓度的CH3COOH溶液与CH3COO Na溶液等体积混合,所得溶液呈碱性
C. 该温度下,1mol/L的醋酸溶液中,醋酸的电离度为0.4%
D. 该温度下,浓度均为0.02mol/L的CH3COONa溶液和AgNO3溶液等体积混合(忽略混合后溶液体积的变化),有CH3COOAg沉淀生成
参考答案:
【答案】C
【解析】醋酸溶液存在电离平衡:CH3COOH![]() CH3COO-+H+和H2O
CH3COO-+H+和H2O![]() H++OH-,从中可知:c(H+)>c(CH3COO-) >c(OH-),A错误;CH3COO Na溶液水解平衡常数为Kh=KW/Ka=10-14/1.6×10-5=6.25×10-10,而CH3COOH的电离常数Ka=1.6×10-5,所以醋酸的电离能力大于醋酸钠的水解能力,因此将相同浓度的CH3COOH溶液与CH3COONa溶液等体积混合,所得溶液呈酸性,B错误;根据电离方程式CH3COOH
H++OH-,从中可知:c(H+)>c(CH3COO-) >c(OH-),A错误;CH3COO Na溶液水解平衡常数为Kh=KW/Ka=10-14/1.6×10-5=6.25×10-10,而CH3COOH的电离常数Ka=1.6×10-5,所以醋酸的电离能力大于醋酸钠的水解能力,因此将相同浓度的CH3COOH溶液与CH3COONa溶液等体积混合,所得溶液呈酸性,B错误;根据电离方程式CH3COOH![]() CH3COO-+H+,假设1mol/L的醋酸溶液中,醋酸的电离度为0.4%,即有4×10-3 mol/L CH3COOH分子发生电离,产生的氢离子和醋酸根离子的浓度均为4×10-3 mol/L ,则醋酸的电离常数Ka=c(H+)×c(CH3COO-)/ c(CH3COOH)= 4×10-3×4×10-3/(1- 4×10-3)= 1.6×10-5,与题给醋酸平衡常数相同,C正确;溶液等体积混合,混合后c(CH3COO-)=0.01 mol/L,c(Ag+)=0.01 mol/L,根据CH3COOAg浓度商= c(Ag+)×c(CH3COO-)=0.01×0.01=1×10-4 <Ksp(CH3COOAg)=3.7×10-3,所以没有沉淀产生,D错误;正确选项C。
CH3COO-+H+,假设1mol/L的醋酸溶液中,醋酸的电离度为0.4%,即有4×10-3 mol/L CH3COOH分子发生电离,产生的氢离子和醋酸根离子的浓度均为4×10-3 mol/L ,则醋酸的电离常数Ka=c(H+)×c(CH3COO-)/ c(CH3COOH)= 4×10-3×4×10-3/(1- 4×10-3)= 1.6×10-5,与题给醋酸平衡常数相同,C正确;溶液等体积混合,混合后c(CH3COO-)=0.01 mol/L,c(Ag+)=0.01 mol/L,根据CH3COOAg浓度商= c(Ag+)×c(CH3COO-)=0.01×0.01=1×10-4 <Ksp(CH3COOAg)=3.7×10-3,所以没有沉淀产生,D错误;正确选项C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法中正确的是
A. 分子中共价键键能越高,键长越长,则分子越稳定
B. 元素周期表中的ⅡA族和ⅦA族元素的原子间不能形成共价键
C. 水分子可表示为H—O—H,分子中键角为180°
D. N—N、N===N、N≡N键能之比为1.00:2.17:4.90,说明N2分子中π键键能>σ键键能
-
科目: 来源: 题型:
查看答案和解析>>【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是()
A. 56g铁片投入足量浓硫酸中生成NA个SO2分子
B. 氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA
C. 1L 0.1mol/LNaHSO4溶液中含有HSO4—总数为0.1NA
D. 一定条件下,向恒容容器中充入3molH2(g)和1molN2(g)发生反应,N2(g)+3H2(g)
 2NH3(g)△H= - Q KJ/mol, 当该反应放出0.25 QKJ的热量时,容器中的氢分子数共有2.25 NA
2NH3(g)△H= - Q KJ/mol, 当该反应放出0.25 QKJ的热量时,容器中的氢分子数共有2.25 NA -
科目: 来源: 题型:
查看答案和解析>>【题目】药物麻黄碱和牛磺酸的结构简式如图。有关麻黄碱、牛磺酸的叙述正确的是

A. 分子式分别为 C10H16ON、C2H7NO2S
B. 均能与金属钠及氢氧化钠溶液反应
C. 均能发生取代反应,麻黄碱还能发生加成反应
D. 牛磺酸与HSCH2CH( NH2)COOH( 半胱氨酸) 互为同系物
-
科目: 来源: 题型:
查看答案和解析>>【题目】按要求填空:
(1)羟基的电子式是
(2)写出2,4,6﹣三硝基甲苯的结构简式
(3) 的系统命名是:
的系统命名是:
(4) 的键线式是
的键线式是
(5) 的单体结构简式为:
的单体结构简式为:
(6)苯与浓硫酸、浓硝酸的混合酸在60℃时发生取代反应:
(7)丙烯在催化剂的条件下制取聚丙烯的反应方程式:
(8)2﹣溴丙烷→丙烯的反应方程式: . -
科目: 来源: 题型:
查看答案和解析>>【题目】溶液、胶体和浊液三种分散系,其分散质的根本区别是
A.是否产生丁达尔效应B.分散质微粒直径的大小
C.是否均一、稳定、透明D.是否能透过滤纸、半透膜
-
科目: 来源: 题型:
查看答案和解析>>【题目】常温下,用0.100mol/L 的AgNO3溶液滴定50.0mL,0.0500mol/L KCl溶液,以K2CrO4为指示剂,测得溶液中pCl=-lgc(Cl-) 、pAg=-lgc(Ag+)随加入AgNO3的体积变化如图所示,已知溶液中离子浓度小于等于1.0×10-5mol/L则沉淀完全,Ksp(Ag2CrO4)=2.0×10-12,Ksp(Ag2SO4)=1.4×10-5,下列说法错误的是( )
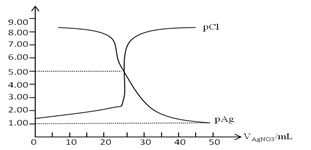
A. AgCl的沉淀溶解平衡常数Ksp数量级为10-10
B. 为防止指示剂失效,溶液应维持中性或弱碱性
C. 滴定中指示剂的有效浓度应维持在2.0×10-2 mol/L
D. 滴定完后加入1mL 0.01mol/L H2SO4会产生新的沉淀
相关试题

