【题目】在容积固定容器中,发生反应2HI(g)![]() H2(g)+I2(g), 下列方法中能证明已达到平衡状态的是( )
H2(g)+I2(g), 下列方法中能证明已达到平衡状态的是( )
①混合气体的颜色不再变化 ②![]() 各组分浓度相等 ③
各组分浓度相等 ③![]()
④一个H-H键断裂的同时有两个H-I键断裂 ⑤混合气体的平均摩尔质量不再变化
A. ①④ B. ①②④ C. ①③⑤ D. ①④⑤
参考答案:
【答案】A
【解析】分析:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
详解:①容器内气体颜色不再变化,说明碘的浓度不变,正逆反应速率相等,正确;
②各组分浓度相等,但相等并不是不变,不能说明反应达到平衡状态,错误;
③反应速率v正(H2)=2v逆(HI),而速率之比与计量数不成比例,反应没有达到平衡状态,错误;
④一个H-H键断裂等效于两个H-I键形成的同时有两个H-I键断裂,说明正逆反应速率相等,反应达到平衡状态,正确;
⑤混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量和物质的量均是不变,所以混合气体的平均摩尔质量不再变化不能说明反应达到平衡状态,错误;所以①④正确;答案选A。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是利用废铜屑(含杂质)制备胆矾(硫酸铜晶体)的过程
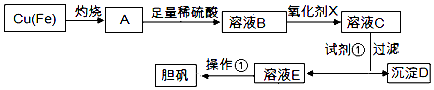
已知:溶液中被沉淀的离子
Fe3+
Fe2+
Cu2+
完全生成氢氧化物的沉淀时,溶液的pH
≥3.7
≥6.4
≥4.4
请回答:
(1)下列物质中最适宜做氧化剂X的是(填字母).
A.NaClO
B.H2O2
C.KMnO4
D.FeCl3
(2)加入试剂①是为了调节pH,试剂①可以选择(填化学式).
(3)操作①的名称是 .
(4)沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是 .
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
C.将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是(用离子方程式表示).
(6)若用碳电极电解硫酸铜溶液200mL.通电5min后,阴极增重0.64g,则电解后溶液的pH=(溶液体积变化忽略不计). -
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法中不正确的是( )
A. H与O可形成既含极性共价键又含非极性共价键的化合物
B. 28g由 C2H4和 C3H6组成的混合物中,H原子的数目为4NA
C. 在D218O中,质量数之和是质子数之和的两倍
D. 1mol —CH3中含有的电子数为9NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )
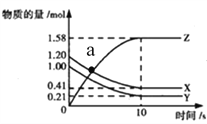
A. 反应的化学方程式为X(g)+Y(g)===Z(g)
B. a点正、逆反应速率相等
C. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
D. 反应开始到10s,Y转化率为79%
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )

A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn
C. SO42-移向X电极,Y电极上有氢气产生
D. X极上发生的是还原反应,Y极上发生的是氧化反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知正四面体形分子E和直线型分子G反应,生成四面体形分子L和双原子分子M.(组成E分子的元素的原子序数都小于10,组成G分子的元素为第三周期的元素.)如图,则下列判断中正确的是( )
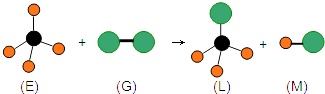
A.常温常压下,L是一种液态有机物
B.E中化学键是极性键
C.G有漂白性
D.上述反应的类型是加成反应 -
科目: 来源: 题型:
查看答案和解析>>【题目】某烃的结构简式为
 ,下列对它的描述正确的是( )
,下列对它的描述正确的是( )A. 它能使溴水褪色,但不能使酸性高锰酸钾溶液褪色
B. 所有原子可能共平面
C. 易溶于水,也易溶于有机溶剂
D. 能发生加成反应,一定条件下最多可与三倍物质的量的氢气加成
相关试题

