【题目】【选做题——物质结构与性质】
早期发现的一种天然二十面体准晶颗粒由 Al、Cu、Fe 三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___________方法区分晶体、准晶体和非晶体。
(2)基态Fe原子有个___________个未成对电子。Fe3+的电子排布式为_____________ 。
(3)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为__________,1 mol乙醛分子中含有的σ键的数目为______________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有___________个铜原子。锗也是一种半导体材料,Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键,从原子结构角度分析,原因是_______________________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图

镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=_____________(填数值);氢在合金中的密度为_____________。
参考答案:
【答案】(1)X射线衍射(1分)(2)4(1分)1s22s22p63s23p63d5或[Ar]3d5 (1分)
(3)sp3、sp2 ,6NA(1分)16 Ge原子半径较大,难以形成稳定的π键,不易形成双键或叁键(4)5;0.083g/cm3
【解析】
试题分析:(1)从外观无法区分三者,但用X光照射挥发现:晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无衍射现象即可确定;
(2)26号元素Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,可知在3d上存在4个未成对电子,失去电子变为铁离子时,先失去4s上的2个电子后失去3d上的1个电子,因此Fe3+的电子排布式为1s22s22p63s23p63d5;
(3)乙醛中甲基上的C形成4个σ键,无孤电子对,因此采取sp3杂化类型,醛基中的C形成3个σ键和1个π键,无孤电子对,采取sp2杂化类型;1个乙醛分子含有6个σ键和一个π键,则1mol乙醛含有6molσ键,即6NA个σ键;该晶胞中O原子数为4×1+6×![]() +8×
+8×![]() =8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个;由于Ge原子半径较大,难以形成稳定的π键,因此不易形成双键或叁键。
=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个;由于Ge原子半径较大,难以形成稳定的π键,因此不易形成双键或叁键。
(4)Ca、D合金化学式为CaD5,镧镍合金与上述合金都具有相同类型的晶胞结构XYn,所以该镧镍合金中n=5;该物质密度=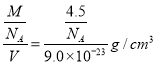 =0.083 g/cm3。
=0.083 g/cm3。
-
科目: 来源: 题型:
查看答案和解析>>【题目】将250C 101KPa条件下的氯化氢(HCl)气体49.0L,通入492mL水中,(已知水的密度为:1.00g/mL),得到密度为1.13g/mL的盐酸(即氯化氢的水溶液)。注:250C 101KPa条件下气体摩尔体积为24.5L/mol。(计算结果保留一位小数)
(1)求此盐酸的物质的量浓度?
(2)取出20.0 mL该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)标准状况下,1.806×1022个NH3分子的体积为 ,氢原子的物质的量为 ,溶于水形成200ml溶液所得氨水的物质的量浓度为 。
(2)将7.1g Na2SO4溶于水配成200mL溶液,溶液中Na+的物质的量浓度为__________。向该溶液中加入一定量NaCl固体,使溶液中Na+的物质的量浓度为0.6mol·L-1(假设溶液体积不变)需加入NaCl的质量为__________。
(3)有FeCl2、CuCl2混合溶液400 mL,经测定其中Cl- 浓度是a mol / L。投入过量的锌粉b g,充分反应后过滤,所得固体残渣洗涤干燥后,质量为c g。则原混合溶液中Fe2+是_________ mol / L,Cu2+是_________mol / L。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关物质的性质和用途的描述均正确的是( )
A. 二氧化锰具有强氧化性.能将双氧水氧化为氧气
B. 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
C. 炭具有还原性,可用炭在高温下将二氧化硅还原为硅
D. .汽油是常见的有机溶剂,可以用裂化汽油来萃取漠水中的溴
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图1。由图中可以看出,该同学在操作时的一个错误是 ,烧杯的实际质量为 g。

需配制250mL 0.2mol·L﹣1NaCl溶液,如图2是该同学转移溶液的示意图。
(2)指出实验中存在的两个错误: 、 .
(3)用质量分数为98%密度为1.84g·cm﹣3的浓硫酸配制1 000mL 0.1mol·L﹣1稀硫酸。
①应用量筒量取浓硫酸 mL。
②配制硫酸溶液时需要用到的仪器有 (除量筒外,写出其余四种)。
③若出现如下情况,对所配溶液浓度将有何影响(填偏高、偏低或无影响)?
没有进行洗涤烧杯玻璃棒操作 ;
倒转容量瓶摇匀后,液面降至刻度线下,再加水至刻度__________;
定容时仰视____________________;
用量筒量取浓硫酸时仰视 ;
④若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度线应 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法正确的是
A.2.5mol/L NaCl溶液含2.5NA个Cl-
B.在标准状况下,22.4L水的质量约为18g
C.22g二氧化碳与标准状况下11.2LHCl含有相同的分子数
D.在同温同压下,相同体积的任何气体单质所含的原子数相同
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知某条件下,合成氨反应的数据如下:
N2(g)+ 3H2(g)
 2NH3(g)
2NH3(g)起始浓度/mol·L-1 1.0 3.0 0.2
2 s末浓度/mol·L-1 0.6 1.8 1.0
4 s末浓度/mol·L-1 0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是( )
A.2 s末氨气的反应速率为0.4 mol·L-1·s-1
B.前2 s时间内氨气的平均反应速率为0.4 mol·L-1·s-1
C.前4 s时间内氨气的平均反应速率为0.3 mol·L-1·s-1
D.2~4 s时间内氨气的平均反应速率为0.2 mol·L-1·s-1
相关试题

