【题目】有机物X、Y、Z的分子式均为C7H8,结构简式如图。下列说法正确的是
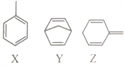
A. X、Y、Z分子中碳原子均能处在同一平面上
B. X、Y、Z三种有机物均能使酸性高锰酸钾溶液褪色
C. 1molX与Z的混合物中含有3mol碳碳双键
D. Y的一氯代物有4种
参考答案:
【答案】B
【解析】A.根据苯分子中12个原子共平面X分子中碳原子均能处在同一平面上, 根据甲烷为正四面体结构,Y、Z分子中含有烷基,分子中碳原子不可能能均处在同一平面上,选项B错误;B. X、Y、Z三种有机物均能使酸性高锰酸钾溶液褪色,其中甲苯苯环侧键易被氧化,Y、Z中含有碳碳易被氧化,选项B正确;C. 苯环中不含有碳碳双键,则X中没有碳碳双键,选项C错误;D. Y的一氯代物有3种,取代位置如图![]() ,选项D错误。答案选B。
,选项D错误。答案选B。
-
科目: 来源: 题型:
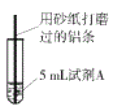
查看答案和解析>>【题目】研究小组进行右图所示实验,试剂A为0.2mol/LCuSO4溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和CuSO4溶液、CuCl2溶液反应的影响因素。用不同的试剂A进行实验1~实验4,并记录实验现象:
实验序号
试剂A
实验现象
1
0.2mol/LCuCl2溶液
铝条表面有气泡产生,并有红色固体析出
2
0.2mol/LCuSO4溶液,再加入一定质量的NaCl固体
开始铝条表面无明显变化,加NaCl后,铝条表面有气泡产生,并有红色固体析出
3
2mol/LCuSO4溶液
铝条表面有少量气泡产生,并有少量红色固体
4
2mol/LCuCl2溶液
反应非常剧烈,有大量气泡产生,溶液变成棕褐色,有红色固体和白色固体生成
(1)实验1中,铝条表面析出红色固体的反应的离子方程式为_________。
(2)实验2的目的是证明铜盐中的阴离子Cl-是导致实验1中反应迅速发生的原因,实验2中加入NaCl固体的质量为______g。
(3)实验3的目的是_________ 。
(4)经检验可知,实验4中白色固体为CuCl。甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl的反应,他设计了右图所示实验证明该反应能够发生。
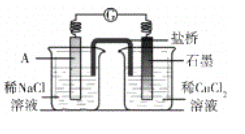
①A极的电极材料是_________。
②能证明该反应发生的实验现象是_________ 。
(5)为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:
实验序号
实验操作
实验现象
i
加入浓NaCl溶液
沉淀溶解,形成无色溶液
ii
加入饱和AlCl3溶液
沉淀溶解,形成褐色溶液
iii
向i所得溶液中加入2mol/LCuCl2溶液
溶液由无色变为褐色
查阅资料知:CuCl难溶于水,能溶解在Cl-浓度较大的溶液中,生成[CuCl2]
-络离子,用水稀释含[CuCl2]-的溶液时会重新析出CuCl沉淀。 ①由述球实验及资料可推断,实验4中溶液呈棕褐色的原因可能是[CuCl2]-与_____作用的结果。
②为确证实验4所得的棕褐色溶液中含有[CuCl2]-,应补充的实验是_______。
(6)上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与______有关。
-
科目: 来源: 题型:
查看答案和解析>>【题目】按要求填空:
(1)实验室用加热二氧化锰和浓盐酸制氯气,离子方程式为____________________。若生成标准状况下2.24 L Cl2,则被氧化的HCl的物质的量为 _______________。
(2)向淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,反应的离子方程式为_______________________________________。
(3)①乙醇 ②MgCl2晶体 ③蔗糖 ④铜 ⑤食盐水 ⑥BaSO4 ⑦次氯酸
以上物质中属于电解质的是(填序号)_____________________________________。
(4)在甲、乙两个烧杯中,分别含有下列离子中的三种:Cu2+、Na+、H+、SO42-、CO32-、OH-。已知甲烧杯中的溶液呈蓝色,则乙烧杯中的溶液中大量存在的离子是_____________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】二甲醚是一种绿色、可再生的新能源。右图是绿色电源“二甲醚燃料电池”的工作原理示意图(a 、b均为多孔性Pt电极)该电池工作时,下列说法中正确的是
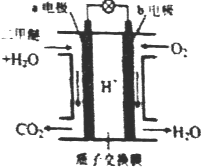
A. a电极为该电池正极
B. 电池工作时,燃料电池内部H+从b电极移向a电极
C. 电池工作时,b电极反应式:O2+4e-+2H2O=4OH-
D. 电池工作时,a电极反应式:CH3OCH3-12e-+3H2O=2CO2↑+12H+
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C、D是原子序数依次增大的第二、三周期主族元素,A、B、C的单质(用a、b、c表示)与化合物x、y、z有如图所示的转化关系,B与D同主族。下列说法正确的是

A. 化合物y阴阳离子个数比为1:1
B. 简单离子半径:D>C>B
C. 最高价氧化物对应的水化物的酸性:A>D
D. A与D形成的化合物AD2中各原子均满足8电子稳定结构
-
科目: 来源: 题型:
查看答案和解析>>【题目】据最近媒体报道,化学研究人员开发了一种可充电锌空气电池,这种电池的电解质溶液为KOH溶液,储电量是锂电池的五倍,而且更安全、更环保,未来或许可以取代锂电池,用在智能手机等电子设备中,其反应原理为2Zn+O2+4KOH+2H2O
 2K2Zn(OH)4。下列说法正确的是
2K2Zn(OH)4。下列说法正确的是A. 放电时,负极反应式为Zn+2e-4OH-=Zn(OH)↓
B. 放电时,电路中通过4mol电子,消耗22.4L氧气
C. 充电时,电解质溶液中OH-浓度逐渐增大
D. 充电时,电解质溶液中K+向正极移动,且发生氧化反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】向含有2molSO2的恒容容器中通入过量氧气发生反应:2SO2(g)+O2(g)
 2SO3(g) ΔH<0,下列说法中正确的是
2SO3(g) ΔH<0,下列说法中正确的是A. 氧气过量,所以充分反应后可生成2molSO3
B. 反应达平衡的过程中,混合气体的平均相对分子质量不断减小
C. 反应达平衡后,升高温度,SO2的转化率减小
D. 反应达平衡后,增大SO2的浓度,平衡右移,故SO2的转化率增大
相关试题

