【题目】向含有2molSO2的恒容容器中通入过量氧气发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,下列说法中正确的是
2SO3(g) ΔH<0,下列说法中正确的是
A. 氧气过量,所以充分反应后可生成2molSO3
B. 反应达平衡的过程中,混合气体的平均相对分子质量不断减小
C. 反应达平衡后,升高温度,SO2的转化率减小
D. 反应达平衡后,增大SO2的浓度,平衡右移,故SO2的转化率增大
参考答案:
【答案】C
【解析】
A. 因为2SO2(g)+O2(g)![]() 2SO3(g)尽管氧气过量,但可逆反应也不能进行彻底,所以不可能生成2 mol SO3。故A错;B. 反应达平衡的过程中,混合气体的平均相对分子质量就等于摩尔质量为M=
2SO3(g)尽管氧气过量,但可逆反应也不能进行彻底,所以不可能生成2 mol SO3。故A错;B. 反应达平衡的过程中,混合气体的平均相对分子质量就等于摩尔质量为M=![]() 因n减小,m不变,混合气体的平均相对分子质量不断增大,故B错;C. 因为 2SO2(g)+O2(g)
因n减小,m不变,混合气体的平均相对分子质量不断增大,故B错;C. 因为 2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0是个放热反应,反应达平衡后,升高温度,SO2的转化率减小,故C正确;D. 反应达平衡后,增大SO2的浓度,平衡右移,故SO2的转化率=
2SO3(g) ΔH<0是个放热反应,反应达平衡后,升高温度,SO2的转化率减小,故C正确;D. 反应达平衡后,增大SO2的浓度,平衡右移,故SO2的转化率=![]() 增大SO2的浓度,相当于SO2
增大SO2的浓度,相当于SO2![]() 增大,所以SO2的转化率减小,故C正确;D. 反应达平衡后,增大SO2的浓度,平衡右移,故SO2的转化率增大故D错。
增大,所以SO2的转化率减小,故C正确;D. 反应达平衡后,增大SO2的浓度,平衡右移,故SO2的转化率增大故D错。
-
科目: 来源: 题型:
查看答案和解析>>【题目】有机物X、Y、Z的分子式均为C7H8,结构简式如图。下列说法正确的是
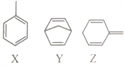
A. X、Y、Z分子中碳原子均能处在同一平面上
B. X、Y、Z三种有机物均能使酸性高锰酸钾溶液褪色
C. 1molX与Z的混合物中含有3mol碳碳双键
D. Y的一氯代物有4种
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C、D是原子序数依次增大的第二、三周期主族元素,A、B、C的单质(用a、b、c表示)与化合物x、y、z有如图所示的转化关系,B与D同主族。下列说法正确的是

A. 化合物y阴阳离子个数比为1:1
B. 简单离子半径:D>C>B
C. 最高价氧化物对应的水化物的酸性:A>D
D. A与D形成的化合物AD2中各原子均满足8电子稳定结构
-
科目: 来源: 题型:
查看答案和解析>>【题目】据最近媒体报道,化学研究人员开发了一种可充电锌空气电池,这种电池的电解质溶液为KOH溶液,储电量是锂电池的五倍,而且更安全、更环保,未来或许可以取代锂电池,用在智能手机等电子设备中,其反应原理为2Zn+O2+4KOH+2H2O
 2K2Zn(OH)4。下列说法正确的是
2K2Zn(OH)4。下列说法正确的是A. 放电时,负极反应式为Zn+2e-4OH-=Zn(OH)↓
B. 放电时,电路中通过4mol电子,消耗22.4L氧气
C. 充电时,电解质溶液中OH-浓度逐渐增大
D. 充电时,电解质溶液中K+向正极移动,且发生氧化反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列各组物质中互为同分异构体的是
A.石墨和金刚石B.H2O和H2O2C.1H和2HD.正丁烷和异丁烷
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列气体不能用向上排空气法收集的是
A. NO B. NO2 C. CO2 D. Cl2
相关试题

