【题目】某硫酸铵样品中混有硫酸氢铵。称取不同质量的样品分别于100mL 2.300mol/L的氢氧化钠溶液充分反应,得到的实验数据入下表:
实验序号 | Ⅰ | Ⅱ |
样品质量(g) | 14.35 | 28.70 |
氨气质量(g) | 3.570 | 3.570 |
下列说法错误的是
A. 样品中硫酸铵与硫酸氢铵的物质的量之比为9:1
B. 实验Ⅰ中氢氧化钠一定过量
C. 要使实验Ⅱ的样品完全反应,需要再加入氢氧化钠0.2100mol
D. 样品中氮元素的质量分数是20.49%
参考答案:
【答案】A
【解析】
A.实验Ⅰ中固体混合物完全反应,令硫酸铵、硫酸氢铵的物质的量分别为xmol、ymol,根据二者质量及生成氨气质量列方程,则:132x+115y=14.35、2x+y=3.5717,解得x=0.1、y=0.01,故样品中硫酸铵与硫酸氢铵的物质的量之比为0.1mol:0.01mol=10:1,故A错误;
B.首先发生反应:H++OH-=H2O,然后发生反应:NH4++OH-![]() NH3↑+H2O,NaOH的量一定,实验Ⅰ、Ⅱ都是生成氨气,说明混合物中H+完全反应,实验Ⅱ中固体混合物质量较大,而生成氨气相等,说明实验Ⅰ中氢氧化钠有剩余,否则,实验Ⅱ中生成的氨气应较少,故B正确;
NH3↑+H2O,NaOH的量一定,实验Ⅰ、Ⅱ都是生成氨气,说明混合物中H+完全反应,实验Ⅱ中固体混合物质量较大,而生成氨气相等,说明实验Ⅰ中氢氧化钠有剩余,否则,实验Ⅱ中生成的氨气应较少,故B正确;
C.28.70g固体中硫酸铵的物质的量=0.1mol×28.7g/14.35g=0.2mol、硫酸氢铵的物质的量=0.01mol×28.7g/14.35g=0.02mol,完全反应时,溶液中溶质为硫酸钠,根据守恒可知,n(NaOH)=2n(Na2SO4)=(0.2mol+0.02mol)×2=0.44mol,故需要加入NaOH的物质的量=0.44mol-0.1L×2.3mol/L=0.2100mol,故C正确;
D.利用实验Ⅰ中的数据计算,根据氮元素守恒可知,混合物中N元素质量=14g/mol×3.57g÷17g/mol=2.94g,故混合物中N元素质量分数=2.94g÷14.35g×100%=20.49%,故D正确。
故选A。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关实验原理或操作正确的是
图1
 图2
图2
A. 选择合适的试剂,用图1所示装置可制取和收集少量CO2、NO和O2
B. 实验室制备氢氧化铝时,可向硫酸铝溶液中逐滴加入稀氨水
C. 可用图 2装置分离碘和四氯化碳溶液
D. 配制100mL 0.1 mol/L NaCl溶液时,用托盘天平准确称取NaCl固体5.85g
-
科目: 来源: 题型:
查看答案和解析>>【题目】某固体酸燃料电池以CHSO4固体为电解质传递OH一,其基本结构见下图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法不正确的是

A. 电子通过外电路从a极流向b极
B. b电极为正极
C. a极上的电极反应式为:H2-2e-=== 2 H+
D. 该装置能将化学能转变为电能
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关实验装置进行的相应实验,不能达到实验目的的是( )

A. 用图1所示装置除去Cl2中含有的少量HCl
B. 用图2所示装置蒸发KCl溶液制备无水KCl
C. 用图3所示装置可以完成“喷泉”实验
D. 用图4所示装置制取干燥纯净的NH3
-
科目: 来源: 题型:
查看答案和解析>>【题目】几种无机物之间转化关系如下图(反应条件省略。部分产物省略)。下列推断不正确的是
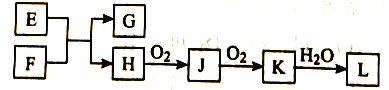
A. 若L为强碱,则E可能为NaCl溶液、F为钾
B. 若L为强酸,则E可能为NaHS、F为HNO3
C. 若L为弱酸,则E可能为Mg、F为CO2
D. 若L为强酸,则E可能为NH4Cl、F为Ca(OH)2
-
科目: 来源: 题型:
查看答案和解析>>【题目】有关物质的转化关系如下图所示(部分物质和条件已经略去)。已知D是化学实验室中常见的淡黄色固体,B、C为常见气体单质,F是常见的液体;K是肉类食品常用的食品添加剂。

请回答下列问题:
(1)D的电子式为_____________。
(2)H的化学式为_____________。
(3)写出反应①的化学方程式:__________________________________________;
(4)写出反应②的离子方程式:__________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质的转化在给定条件下能实现的是( )
①盐卤(含MgCl2)
 Mg(OH)2
Mg(OH)2 MgCl2溶液
MgCl2溶液 无水MgCl2
无水MgCl2②铝土矿
 AlO2-
AlO2- Al(OH)3
Al(OH)3 Al2O3
Al2O3③NH3
 NO
NO NO2
NO2 HNO3
HNO3④NaCl溶液
 Cl2
Cl2 无水FeCl2
无水FeCl2⑤S
 SO3
SO3 H2SO4
H2SO4⑥SiO2
 Na2SiO3溶液
Na2SiO3溶液 H2SiO3
H2SiO3A. ③⑥B. ③⑤⑥C. ①④⑤D. ①③⑥
相关试题

