【题目】某固体酸燃料电池以CHSO4固体为电解质传递OH一,其基本结构见下图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法不正确的是

A. 电子通过外电路从a极流向b极
B. b电极为正极
C. a极上的电极反应式为:H2-2e-=== 2 H+
D. 该装置能将化学能转变为电能
参考答案:
【答案】C
【解析】
A.根据总反应可知氢元素的化合价升高,失去电子,则通入氢气的一极为负极,则a为负极,b为正极,电子通过外电路从负极流向正极,所以电子应该是通过外电路由a极流向b,故A正确;
B.通入氧气的一极为正极,则b电极为正极,故B正确;
C.由题意可知,该燃料电池以CHSO4固体为电解质传递OH-,则a极上的电极反应式为:H2+2OH--2e-=2H2O,故C错误;
D.该装置为固体酸燃料电池,能将化学能转变为电能,故D正确。
故选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关铜的化合物说法正确的是( )
A. 根据铁比铜金属性强,在实际应用中可用FeCl3腐蚀Cu刻制印刷电路板
B. CuSO4溶液与H2S溶液反应的离子方程式为:Cu2++S2-
 CuS↓
CuS↓C. 用稀盐酸除去铜锈的离子方程式为CuO+2H+===Cu2++H2O
D. 化学反应:CuO+CO
 Cu+CO2的实验现象为黑色固体变成红色固体
Cu+CO2的实验现象为黑色固体变成红色固体 -
科目: 来源: 题型:
查看答案和解析>>【题目】铝及其化合物在生产生活中有着广泛的用途。
Ⅰ.高岭土化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。用高岭土制备碱式氯化铝的工艺流程如下:

根据流程图回答下列问题:
(1)实验室配制4mol/L的盐酸1000mL需要用到的玻璃仪器有烧杯、玻璃棒、量筒、____________________等。
(2)加适量铝粉时所发生的离子反应方程式为________________________________。
Ⅱ.铝和镁的碱式碳酸盐(AlxMgy(OH)z(CO3)w·nH2O)是一种中和胃酸过多的常用药物,某化学兴趣小组通过以下实验探究该药物主要成分的化学式:
甲同学取该碱式盐9.03 g充分灼烧至恒重,测得剩余固体质量为5.13 g;
乙同学取相同质量的碱式盐使其溶于足量的盐酸中,收集到气体体积为336mL(已换算为标准状况);继续向溶液中加入足量的NaOH溶液得到5.22 g白色沉淀。试通过计算确定该碱式碳酸盐的化学式________。(写出计算过程,只有答案不给分)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关实验原理或操作正确的是
图1
 图2
图2
A. 选择合适的试剂,用图1所示装置可制取和收集少量CO2、NO和O2
B. 实验室制备氢氧化铝时,可向硫酸铝溶液中逐滴加入稀氨水
C. 可用图 2装置分离碘和四氯化碳溶液
D. 配制100mL 0.1 mol/L NaCl溶液时,用托盘天平准确称取NaCl固体5.85g
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关实验装置进行的相应实验,不能达到实验目的的是( )

A. 用图1所示装置除去Cl2中含有的少量HCl
B. 用图2所示装置蒸发KCl溶液制备无水KCl
C. 用图3所示装置可以完成“喷泉”实验
D. 用图4所示装置制取干燥纯净的NH3
-
科目: 来源: 题型:
查看答案和解析>>【题目】某硫酸铵样品中混有硫酸氢铵。称取不同质量的样品分别于100mL 2.300mol/L的氢氧化钠溶液充分反应,得到的实验数据入下表:
实验序号
Ⅰ
Ⅱ
样品质量(g)
14.35
28.70
氨气质量(g)
3.570
3.570
下列说法错误的是
A. 样品中硫酸铵与硫酸氢铵的物质的量之比为9:1
B. 实验Ⅰ中氢氧化钠一定过量
C. 要使实验Ⅱ的样品完全反应,需要再加入氢氧化钠0.2100mol
D. 样品中氮元素的质量分数是20.49%
-
科目: 来源: 题型:
查看答案和解析>>【题目】几种无机物之间转化关系如下图(反应条件省略。部分产物省略)。下列推断不正确的是
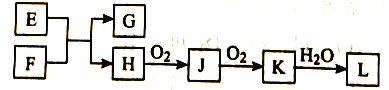
A. 若L为强碱,则E可能为NaCl溶液、F为钾
B. 若L为强酸,则E可能为NaHS、F为HNO3
C. 若L为弱酸,则E可能为Mg、F为CO2
D. 若L为强酸,则E可能为NH4Cl、F为Ca(OH)2
相关试题

