
【题目】(1)T1K时,将1mol二甲醚引入一个抽空的150L恒容容器中,发生分解反应:CH3OCH3(g)CH4(g)+H2(g)+CO(g)。
反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由此计算:反应达平衡时,二甲醚的分解率为______,该温度下平衡常数Kc=______。(填数值)
②若升高温度,CH3OCH3的浓度增大,则该反应为______反应(填“放热”或“吸热”),在恒温恒容下,若要缩短上述反应达到平衡的时间,可采取的措施有______、______。
(2)在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)CH3CHO(g)。反应速率v=v正v逆=k正p(CO)p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5(kPa)-1,当CO转化率为20%时,![]() =______。
=______。
(3)工业上常用高浓度的K2CO3溶液吸收CO2得到溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示:
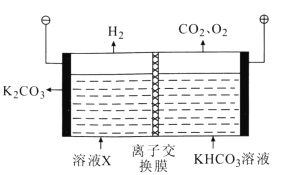
①在阳极区发生的反应包括(电极反应)______和H++![]() =CO2↑+H2O。
=CO2↑+H2O。
②用离子方程式表示![]() 在阴极区再生的过程:______。
在阴极区再生的过程:______。
【答案】75% 7.5×10-5 放热 加入催化剂 增大反应物浓度 ![]() =
=![]() = 4.5×10-5×104×
= 4.5×10-5×104×![]() =
=![]() 2H2O–4e-=4H++O2↑
2H2O–4e-=4H++O2↑ ![]() +OH-=H2O+
+OH-=H2O+![]()
【解析】
(1)①结合三段式计算t=∞时各物质的浓度,利用二甲醚的分解率公式和平衡常数k表达式计算;
②若升高温度,CH3OCH3的浓度增大,说明平衡逆向进行,逆反应为吸热反应;
(2)先通过反应达到平衡时v正=v逆推导出平衡常数kp=![]() ,再利用三段式计算平衡气体分压p(CO)、p(CH4)、p(CH3CHO)计算v正、v逆的比;
,再利用三段式计算平衡气体分压p(CO)、p(CH4)、p(CH3CHO)计算v正、v逆的比;
(3)①在阳极区发生的反应包括(电极反应)水失电子被氧化;②在阴极区水得到电子生成氢气和OH-,![]() 在阴极区再生。
在阴极区再生。
(1)①平衡时反应的三段式
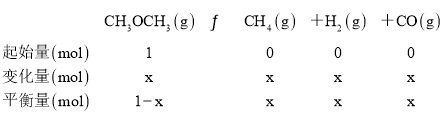
恒温恒容条件下,气体的物质的量之比等于压强之比,即(1+2x):1=125.0kPa:50kPa,x=0.75mol,反应达平衡时,二甲醚的分解率=![]() ×100=75%,c(CH3OCH3)=
×100=75%,c(CH3OCH3)=![]() =
=![]() mol·L-1,c(CH4)=c(H2)=c(CO)=
mol·L-1,c(CH4)=c(H2)=c(CO)=![]() =
=![]() mol·L-1,平衡常数Kc=
mol·L-1,平衡常数Kc=![]() =
=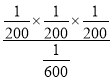 =7.5×10-5;故答案为:75%;7.5×10-5;
=7.5×10-5;故答案为:75%;7.5×10-5;
②若升高温度,CH3OCH3的浓度增大,说明平衡逆向移动,则该反应为放热反应,在恒温恒容下,若要缩短上述反应达到平衡的时间,可采取的措施有加入催化剂、增大反应物浓度。故答案为:放热;加入催化剂;增大反应物浓度;
(2)在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)CH3CHO(g)。反应速率v=v正v逆=k正p(CO)p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5(kPa)-1,当CO转化率为20%时, 反应的三段式为

所以p(CH4)=p(CO)=![]() ×1.0×104kPa=
×1.0×104kPa=![]() ×104kPa,p(CH3CHO)=
×104kPa,p(CH3CHO)=![]() ×1.0×104kPa=
×1.0×104kPa=![]() ×104kPa,
×104kPa,![]() =
=![]() = 4.5×10-5×104×
= 4.5×10-5×104×![]() =
=![]() 。故答案为:
。故答案为:![]() =
=![]() = 4.5×10-5×104×
= 4.5×10-5×104×![]() =
=![]() =0.8;
=0.8;
(3)①在阳极区发生的反应包括(电极反应)水失电子被氧化,2H2O–4e-=4H++O2↑,生成的氢离子与碳酸氢根反应生成二氧化碳和水,H++![]() =CO2↑+H2O。故答案为:2H2O–4e-=4H++O2↑;
=CO2↑+H2O。故答案为:2H2O–4e-=4H++O2↑;
②在阴极区水得到电子生成氢气和OH-,![]() 在阴极区再生的过程:
在阴极区再生的过程:![]() +OH-=H2O+
+OH-=H2O+![]() 。故答案为:
。故答案为:![]() +OH-=H2O+
+OH-=H2O+![]() 。
。


科目:高中化学 来源: 题型:
【题目】从冬青中提取出的有机物A可用于合成抗结肠炎药物Y及其他化学品,合成路线如下图:
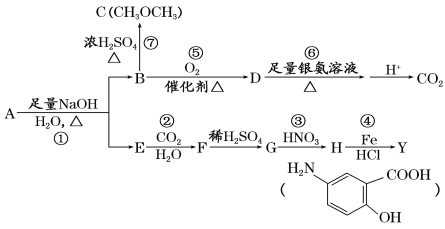
提示: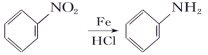
根据上述信息回答:
(1)请写出Y中含氧官能团的名称:__________________。
(2)写出反应③的反应类型:_________________。
(3)写出下列反应的化学方程式:
②______________。
⑤_______________。
(4)A的同分异构体I和J是重要的医学中间体,在浓硫酸的作用下I和J分别生成![]() 和
和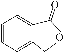 ,鉴别I和J的试剂为_________________。
,鉴别I和J的试剂为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CPAE是蜂胶的主要活性成分,由咖啡酸合成CPAE路线如下:
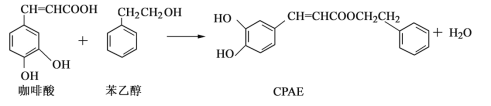
下列说法正确的是
A.可用金属Na检测上述反应是否残留苯乙醇
B.与苯乙醇互为同分异构体的酚类物质共有9种
C.1 mol咖啡酸最多可与含3 mol NaHCO3的溶液发生反应
D.咖啡酸、苯乙醇及CPAE都能发生取代、加成和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组在实验室中模拟利用甲烷和氯气发生取代反应制取副产品盐酸,设计如图装置,下列说法错误的是( )
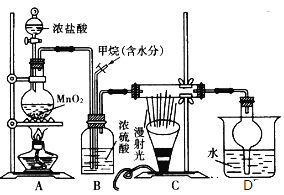
A.实验时先点燃A处酒精灯再通甲烷
B.装置B有均匀混合气体、控制气流速度、干燥混合气体等作用
C.从D中分离出盐酸的方法为过滤
D.装置C经过一段时间的强光照射后,生成的有机物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池是目前应用比较广泛的一种燃料电池,其工作原理如下图所示:

下列说法正确的是( )
A.N为正极,发生氧化反应
B.a为氧气,b为甲醇
C.甲池溶液pH增大,乙池溶液pH减小
D.若有1 mol CO2生成,则有6 mol H+从甲池透过交换膜进入乙池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室为探究铜与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法错误的是( )
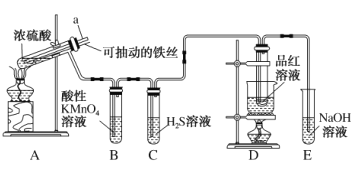
A.装置B、C的目的分别是验证二氧化硫的还原性、氧化性
B.实验结束后可向装置A的溶液中加水,以验证是否有蓝色溶液生成
C.装置D的目的是验证SO2的漂白性及漂白的不稳定性
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰在电解锰、染料、造纸以及陶瓷等工业生产中有广泛的应用。利用软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS)制得硫酸锰的流程如下:
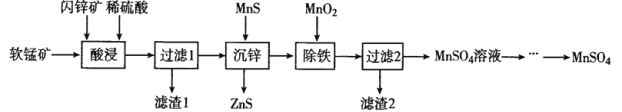
已知:常温下,Ksp(ZnS)=1.2×l0-24、Ksp(MnS)=1.5×10-15
关于该流程说法错误的是
A.“酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是作催化剂。
B.“沉锌”反应为:Zn2+(aq)+MnS(s)![]() ZnS(s)+Mn2+(aq),该反应的平衡常数K为1.25×109
ZnS(s)+Mn2+(aq),该反应的平衡常数K为1.25×109
C.“除铁”时加二氧化锰是为了氧化Fe2+,然后向溶液加适量氨水将溶液pH调节为3~4
D.该流程中可以循环利用的物质是ZnS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.含有OH-的溶液一定呈碱性
B.pH为3的盐酸的c(H+)是pH为1的盐酸的100倍
C.Na2SO3溶液与NaHSO3溶液中所含微粒的种类一定相同
D.pH相同的氨水与氢氧化钠溶液,分别与同浓度同体积的盐酸完全中和时,消耗氨水与氢氧化钠溶液的体积一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人们的生活、生产密切相关。回答下列问题:
(1)微生物作用下,废水中的![]() 可转化为
可转化为![]() ,该反应分两步反应:
,该反应分两步反应:
I:2![]() +(aq)+3O2(g)=2
+(aq)+3O2(g)=2![]() (aq)+4H+(aq)+2H2O(l) △H=-546 kJ·mol-1
(aq)+4H+(aq)+2H2O(l) △H=-546 kJ·mol-1
II:2![]() (aq)+O2(g)=2
(aq)+O2(g)=2![]() (aq) △H=-146 kJ·mol-1
(aq) △H=-146 kJ·mol-1
则低浓度氨氮废水中的![]() (aq)氧化生成
(aq)氧化生成![]() (aq)的热化学方程式为_____。
(aq)的热化学方程式为_____。
(2)在容积固定的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g) △H,随温度升高,混合气体的颜色变深。
2NO2(g) △H,随温度升高,混合气体的颜色变深。
①温度T时反应达平衡,混合气体平衡总压强为p Pa,N2O4气体的平衡转化率为75%,则反应N2O4(g)![]() 2NO2(g)的平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若温度升高,Kp值将_____(填“增大”、“减小”或“不变”)。
2NO2(g)的平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若温度升高,Kp值将_____(填“增大”、“减小”或“不变”)。
②温度T时反应达平衡后,将反应容器的容积减少一半。平衡向____(填“正反应”或“逆反应”)方向移动,判断理由是____。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时间的变化如图所示。下列说法正确的是___(填字母)。
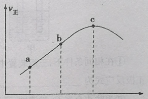
A.逆反应速率:a点小于点c
B.反应在c点达到平衡状态
C.反应物浓度:a点小于b点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com