【题目】请按要求回答下列问题:
(1)某同学设计下图装置进行探究“铜和稀硝酸反应制取NO”的实验(夹持装置已略去),则制取NO的化学方程式为:____________;

利用该装置还可制取并收集少量其他气体,请完成下表:
制取气体 | 药品 |
O2 | __________ |
_______ | 某溶液_________________、Al |
(2)根据图1回答:
①打开K1,合上K2。则此时此装置为 ______;A电极可观察到的现象是____。
(3)根据图2回答:
将纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为_________________。
图2对应的实验完成后,铜电极增重6.4g,石墨电极产生标准状况下的气体体积_____L。

参考答案:
【答案】 3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O H2O2、MnO2 H2 NaOH(或HCl)(答案合理就给分) 电解池 附着红色固体 4OH―-4e―=O2↑ +2H2O 1.12 L
【解析】(1)稀硝酸和铜反应生成硝酸铜、NO和水,则制取NO的化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;该装置是固体和液体或液体和液体之间反应制备气体,如果制备氧气,则需要双氧水和二氧化锰;如果固体是金属铝,常温下能和金属铝反应且生成的气体能用排水法收集,这说明气体是氢气,因此溶液是氢氧化钠溶液或盐酸;
(2)①打开K1,合上K2,则此时此装置为电解池;A电极与电源的负极相连,作阴极,溶液中的铜离子放电,因此A电极可观察到的现象是附着红色固体。
(3)图2装置是电解池,石墨电极和电源正极相连,作阳极,铜电极是阴极。阳极是氢氧根放电,电极反应式为;将纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为4OH―-4e―=O2↑+2H2O。铜电极增重6.4g,即有0.1mol铜析出,转移0.2mol电子,根据电子转移守恒可知生成氧气是0.2mol÷4=0.05mol,在标准状况下的气体体积为0.05mol×22.4L/mol=1.12L。
-
科目: 来源: 题型:
查看答案和解析>>【题目】将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确的是
A. 标准状况下,反应过程中得到7.84 L的气体
B. 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C. 最终得到7.8 g的沉淀
D. 最终得到的溶液中c(Na+)=1.5 mol·L-1
-
科目: 来源: 题型:
查看答案和解析>>【题目】将铁的化合物溶于盐酸,滴加KSCN溶液,不发生颜色变化,再加入适量氯水,溶液立即呈红色的是( )
A. Fe2O3 B. FeCl3 C. Fe2(SO4)3 D. FeO
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关氧化还原反应的说法正确的是 ( )
A. 浓盐酸在化学反应中既可以作氧化剂,又可以作还原剂
B. 工业上常以SiO2为原料制取粗硅,这一过程中,硅元素被氧化
C. 在任何条件下都不能发生反应:Cu + H2SO4=CuSO4+ H2↑
D. 亚氯酸可发生分解反应:HClO2
 ClO2↑+Cl2↑+H2O(未配平),1 mol HClO2分解时,转移电子的物质的量为1 mol
ClO2↑+Cl2↑+H2O(未配平),1 mol HClO2分解时,转移电子的物质的量为1 mol -
科目: 来源: 题型:
查看答案和解析>>【题目】氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×75.77%+36.966×24.23% =35.453中( )
A. 75.77%表示35Cl的质量分数 B. 24.23%表示35Cl的丰度
C. 35. 453表示氯元素的相对原子质量 D. 36.966表示37Cl的质量数
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图为实验室制取自来水的装置示意图,根据图示回答下列问题。
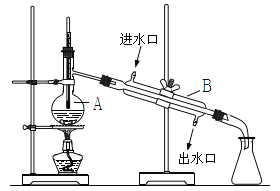
(1)图中的两处明显的错误是____________________、_____________________。
(2)A仪器的名称是______________,B仪器的名称是_______________。
(3)实验时A中除加入少量自来水外,还需加入少量___________,其作用是_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】高三一年的化学复习,学生要抓住两方面,一方面是教材,另一方面是历年的高考真题。每年的高考题,在教材中几乎都能找到影子,所以同学们一定要紧紧抓住教材,根据《必修一》第三章和第四章的内容回答下列问题:
(1)实验3-1是取用钠单质的实验,用品有小刀,_____、_____、培养皿。
(2)铁是人类应用最广泛,铁的氧化物有三种,其中Fe3O4是一种具有_____的黑色晶体,俗称磁性氧化铁.Fe2O3的用途________(举一例)。
(3)氢氧化铝其有两性,写出氢氧化铝分别溶于强酸和强碱的离子方程式_____,_______。
(4)在抗震救灾中要用到大量漂白粉和漂白液杀菌消毒,漂白粉的制取过程如下:通过煅烧石灰石得到生石灰,生石灰溶于水得石灰乳,在向石灰乳中通入氯气反应得漂白粉,有关的反应化学方程式为:CaCO3
 CaO+CO2↑_________、_________。
CaO+CO2↑_________、_________。
相关试题

