【题目】下列有关氧化还原反应的说法正确的是 ( )
A. 浓盐酸在化学反应中既可以作氧化剂,又可以作还原剂
B. 工业上常以SiO2为原料制取粗硅,这一过程中,硅元素被氧化
C. 在任何条件下都不能发生反应:Cu + H2SO4=CuSO4+ H2↑
D. 亚氯酸可发生分解反应:HClO2![]() ClO2↑+Cl2↑+H2O(未配平),1 mol HClO2分解时,转移电子的物质的量为1 mol
ClO2↑+Cl2↑+H2O(未配平),1 mol HClO2分解时,转移电子的物质的量为1 mol
参考答案:
【答案】A
【解析】A. 如与金属发生的置换反应中作氧化剂,在与二氧化锰发生的反应中作还原剂,故A正确;B. 工业上常以SiO2为原料制取粗硅,这一过程中,硅元素化合价降低而被还原,故B错误;C. 在直流电作用下,铜作阳极,硫酸溶液作电解质溶液,发生反应:Cu + H2SO4=CuSO4+ H2↑,故C错误;D.HClO2![]() ClO2↑中Cl的化合价升高1,HClO2
ClO2↑中Cl的化合价升高1,HClO2![]() Cl2↑中Cl的化合价降低3,根据化合价升降数值相等可得8HClO2
Cl2↑中Cl的化合价降低3,根据化合价升降数值相等可得8HClO2![]() 6ClO2↑+Cl2↑,所以1 mol HClO2分解时,转移电子的物质的量为6/8mol=0.75mol,故D错误。故选A。
6ClO2↑+Cl2↑,所以1 mol HClO2分解时,转移电子的物质的量为6/8mol=0.75mol,故D错误。故选A。
-
科目: 来源: 题型:
查看答案和解析>>【题目】水是最普通、最常见的物质之一。
(1)“水”有很多种。下列“水”属于纯净物的是 ________ (填字母序号)。
A.河水 B.自来水 C.矿泉水 D.蒸馏水
(2)电解水可证明水由氢、氧两种元素组成,该反应的化学方程式为________ 。
(3)水是重要的溶剂和化工原料。氯碱工业以饱和食盐水为原料获得烧碱等化工产品,反应原理为:
 。
。 ①20℃时,NaCl 的溶解度是36 g。该温度下,饱和食盐水中溶质与溶剂的质量比为______。
②烧碱可用于处理硫酸泄漏,反应的化学方程式为__________。
(4)水在化学实验中具有重要作用。将铁丝放在潮湿的空气中(如下图所示),一段时间后,观察到导管内液面下降,导管口有气泡冒出,关闭 K。请解释导管内液面上升和下降的原因:___________________________。

-
科目: 来源: 题型:
查看答案和解析>>【题目】将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确的是
A. 标准状况下,反应过程中得到7.84 L的气体
B. 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C. 最终得到7.8 g的沉淀
D. 最终得到的溶液中c(Na+)=1.5 mol·L-1
-
科目: 来源: 题型:
查看答案和解析>>【题目】将铁的化合物溶于盐酸,滴加KSCN溶液,不发生颜色变化,再加入适量氯水,溶液立即呈红色的是( )
A. Fe2O3 B. FeCl3 C. Fe2(SO4)3 D. FeO
-
科目: 来源: 题型:
查看答案和解析>>【题目】请按要求回答下列问题:
(1)某同学设计下图装置进行探究“铜和稀硝酸反应制取NO”的实验(夹持装置已略去),则制取NO的化学方程式为:____________;

利用该装置还可制取并收集少量其他气体,请完成下表:
制取气体
药品
O2
__________
_______
某溶液_________________、Al
(2)根据图1回答:
①打开K1,合上K2。则此时此装置为 ______;A电极可观察到的现象是____。
(3)根据图2回答:
将纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为_________________。
图2对应的实验完成后,铜电极增重6.4g,石墨电极产生标准状况下的气体体积_____L。

-
科目: 来源: 题型:
查看答案和解析>>【题目】氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×75.77%+36.966×24.23% =35.453中( )
A. 75.77%表示35Cl的质量分数 B. 24.23%表示35Cl的丰度
C. 35. 453表示氯元素的相对原子质量 D. 36.966表示37Cl的质量数
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图为实验室制取自来水的装置示意图,根据图示回答下列问题。
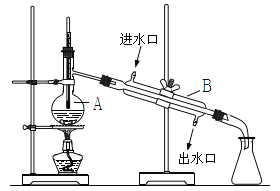
(1)图中的两处明显的错误是____________________、_____________________。
(2)A仪器的名称是______________,B仪器的名称是_______________。
(3)实验时A中除加入少量自来水外,还需加入少量___________,其作用是_________。
相关试题

