【题目】相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积比为( )
A.1:1 B.1:6 C.2:3 D.3:2
参考答案:
【答案】A
【解析】由2Al+6HCl=2AlCl3+3H2↑、2Al+2H2O+2NaOH=2NaAlO2+3H2↑可知,酸、碱均过量,则铝完全反应,铝的物质的量相等,从方程式中可以看到铝与氢气的比例都是2:3,因此产生的氢气是相等的,生成氢气的体积比为1:1,故选A.
-
科目: 来源: 题型:
查看答案和解析>>【题目】Na、Mg、Al、Fe 、Cu是中学阶段常见的几种重要金属元素,请回答以下问题:
(1)Fe在周期表中第____周期,第____族;它的核外电子排布式:_________;
(2)Al的价电子轨道表示式:____________;与其同族中第四周期的元素名称,元素符号____。
(3)Mg的原子结构示意图:____________; Na、Mg、Al第一电离能的由大到小顺序:___________(用元素符号表示)
(4)Cu2+的未成对电子数:____,在硫酸铜溶液中通入氨气直至过量发生的化学反应_____________________________________________(写离子方程式),小心蒸发,最终得到的[Cu(NH3)4]SO4晶体中含有的化学键除了普通共价键外,还有________和________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如图所示。

(1)1 mol H2O形成的冰中有________mol“氢键”。
(2)水分子可电离生成两种含有相同电子数的微粒,其电离方程式为________。
(3)在冰晶体中除氢键外,还存在范德华力(11 kJ·mol-1)。已知冰的升华热是51 kJ·mol-1,则冰晶体中氢键的能量是________ kJ·mol-1。
(4)氨气极易溶于水的原因之一也是与氢键有关。请判断NH3溶于水后,形成的NH3·H2O的合理结构是________(填序号)。
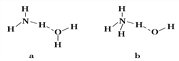
(5)NH3与PH3相比,热稳定性更强的是__________
(6)NH3、PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是____
A.键的极性N—H比P—H强
B.分子的极性NH3比PH3强
C.相对分子质量PH3比NH3大
D.NH3分子之间存在特殊的分子间作用力
-
科目: 来源: 题型:
查看答案和解析>>【题目】周期表里的四种短周期主族元素的相对位置如下所示。已知它们的原子序数总和为38,用元素符号回答以下问题:
m
n
x
y
(1)元素n的原子序数为________;
(2) m、n、x第一电离能的由小到大的顺序:电负性的由大到小的顺序:________。(用元素符号表示)
(3)m、x按照1:2所形成化合物的电子式: ________,分子构型:_____;
(4)用以上任意两种元素写出一个含有极性键的5原子非极性分子式:___
-
科目: 来源: 题型:
查看答案和解析>>【题目】三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:

(1)氯化水解法生产三氯氧磷的化学方程式为___________________________。
(2)氯化水解法生产三氯氧磷时,会产生含磷(主要为H3PO3、H3PO4等)废水,已知H3PO3是一种淡黄色晶体,且易溶于水的二元弱酸。
①若用20 mL H3PO3溶液与同浓度的NaOH溶液40mL恰好完全反应,生成的盐为___________________(填“正盐”或“酸式盐”)。
②H3PO3中,P元素的化合价为_______________________。H3PO3可以将溶液中的Ag+还原,从而用于化学镀银,写出该离子方程式_________________________。
③处理废水时,先在其中加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸钙沉淀并回收,加入漂白粉的作用是______________________________________。
④若处理后的废水中c(PO43ˉ)=4×10ˉ7mol·Lˉ1,溶液中c(Ca2+)=________mol·Lˉ1。(已知Ksp[Ca3(PO4)2]=2×10ˉ29)
(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·Lˉ1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·Lˉ1 NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10ˉ10,Ksp(AgSCN)=2×10ˉ12
①滴定选用的指示剂是__________(选填字母)。
a.FeCl2b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中若未加入硝基苯这项操作,所测Cl元素含量将会_______(填“偏大”、“偏小”或“不变”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2做原料的燃料电池,负极材料采用Pt/C.正极材料采用MnO2,可用做空军通信卫星电源,其工作原理如图所示。下列说法中不正确的是

A. 电池放电时Na+从a极区移向b极区
B. 燃料电池是一类能量转化效率高、环境友好的发电装置
C. 该电池的负极反应为BH4-+ 8OH-一8e-═BO2-+ 6H2O
D. 在电池反应中,每消耗3molH2O2,转移电子数为3NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是

A. a处通入氧气, b处通氢气
B. 通入H2的电极发生反应:H2-2e- = 2H+
C. 通入O2的电极发生反应:O2 + 4e- + 2H2O = 4OH-
D. 该装置将化学能最终转化为电能
相关试题

