【题目】(12分)某种含有少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的含量。实验采用以下步骤进行:
①准确称量m g样品(2~3g);
②向样品中加入10mL 5mol/L的盐酸,再加入蒸馏水,配制成250mL溶液;
③量取25mL操作②中配得的溶液,加入3mL溴水,加热使之完全反应;
④趁热迅速加入浓度为10%的氨水至过量,充分搅拌,使之完全沉淀;
⑤过滤,将沉淀洗涤、灼烧、冷却称量,反复操作至恒重。
请根据上面的叙述回答:
(1)若称量前,托盘天平的指针偏向标尺左方;称量读数时,指针刚好在标尺的中间,则所得样品的质量 。
A.比mg多 B.比mg少 C.恰好为mg
(2)溶解样品时要加入盐酸,原因是 。
(3)配制250mL溶液时,除需250mL的容量瓶、烧杯外,还需用到的玻璃仪器是 。
(4)加入溴水时发生反应的离子方程式是 。
(5)若坩埚质量为W1g,坩埚与灼烧后固体的总质量是W2 g,则样品中铁元素的质量分数是 。
(6)若在配制250mL溶液时,所用的容量瓶没有洗干净。当含有下列物质时,最终会使铁元素的测定含量(填“偏高”、“偏低”或“不变”)。
①NaCl ②Fe2(SO4)3
参考答案:
【答案】B 抑制Fe2+、Fe3+的水解 玻璃棒、胶头滴管 2Fe2++Br2=2Fe3++2Br- ![]() 不变 偏高
不变 偏高
【解析】
(1)称量前,天平指针偏左,说明左盘质量大于右盘质量,称量读数时,指针刚好在标尺的中间,则所得样品的质量偏小,答案选B;
(2)Fe2+、Fe3+能发生水解,加入盐酸,可抑制Fe2+、Fe3+的水解;
(3)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,即还需用到的玻璃仪器是玻璃棒、胶头滴管;
(4)单质溴具有氧化性,能氧化Fe2+生成Fe3+,方程式为2Fe2++Br2=2Fe3++2Br-;
(5)若坩埚质量是W1g,坩埚与最终灼烧后的固体总质量是W2 g则生成的氧化铁质量为(W2-W1)g,25mL溶液中铁元素的质量为![]() g,250mL中含有铁元素质量为
g,250mL中含有铁元素质量为![]() g,所以铁元素质量分数为
g,所以铁元素质量分数为![]() ;
;
(6)①当含有NaCl时,沉淀质量的不变化,所以不影响结果;②当含有Fe2(SO4)3时,沉淀质量的变大,所以铁元素的测定含量偏高。
-
科目: 来源: 题型:
查看答案和解析>>【题目】海洋是一座巨大的化学资源宝库,从中可以提取许多常见的化学物质,结合所学知识回答下列问题,
(1)“吹出法”提溴空气吹出法是工业规模提溴的常用方法,其流程如下:

其中步骤②~④的目的是________________________________________________。步骤③反应的离子方程式为_______________________________________________。除SO2外,步骤③还可以选用Na2CO3溶液吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收1molBr2时,转移电子的物质的量为__________________mol。
(2)实验室模拟从海带中提取碘,可能经历如下操作(或过程),请选择必要的操作(或过程),并按实验的先后顺序排列________________________________________________(填写编号)

仪器X的名称__________________,将X中的液体分离的具体操作为:打开X上端玻璃塞,_______________________________________________________________________________。
(3)卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子。现以卤块为原料按下图流程制备轻质氧化镁,若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,回答下列问题:

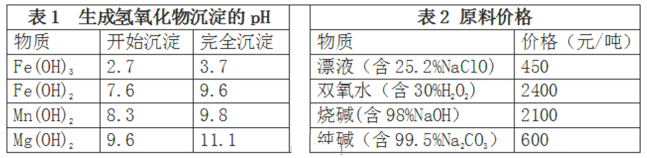
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去。
步骤①反应的离子方程式为:___________________________________________________;
步骤②的反应方程式为:_______________________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】常温下,向1L0.1mol·L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )

A. M点溶液中水的电离程度比原溶液大
B. a=0.05
C. 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
D. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
-
科目: 来源: 题型:
查看答案和解析>>【题目】Ⅰ、反应A(g)+B(g)
 C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
(1)该反应是_________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率_______(填“增大”、“减小”、“不变”)。
(3)反应体系中加入催化剂对反应热是否有影响?_____(填“有”、“无”),原因是____。
(4)在反应体系中加入催化剂,反应速率增大,E1的变化是:E1____(填“增大”、“减小”、“不变”)。
Ⅱ、五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g)
 PCl5(g) △H=-0.930 kJmol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
PCl5(g) △H=-0.930 kJmol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:t/s
0
50
150
250
350
n(PCl5)/mol
0
0.24
0.36
0.40
0.40
(1)50~150s内的平均反应速率v(PCl3)=___________。
(2)该温度下,此反应的化学平衡常数的数值为___________(可用分数表示)。
(3)反应至250s时,该反应放出的热量为______________kJ。
(4)下列关于上述反应的说法中,正确的是__________(填字母序号)。
a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.5molCl2,达到化学平衡状态时,n(PCl5)<0.20mol
(5)温度T1时,混合气体中PCl5的体积分数随时间t变化的示意图如下。其他条件相同,请在下图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线__________。

-
科目: 来源: 题型:
查看答案和解析>>【题目】在容积均为1 L的三个密闭容器中,分别放入铁粉并充入1 mol CO,控制在不同温度下发生反应:Fe(s)+5CO(g)
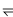 Fe(CO)5(g),当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是( )
Fe(CO)5(g),当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是( )
A. 反应进行到5min时,b容器中v(正)=v(逆)
B. 正反应为吸热反应,平衡常数:K(T1)>K(T2)
C. b中v(正)大于a中v(逆)
D. 达到平衡时,a、b、c中CO的转化率为b>c>a
-
科目: 来源: 题型:
查看答案和解析>>【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是
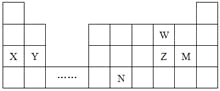
A. 原子半径:Y>Z>W
B. 单质的还原性:X>Y
C. 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
-
科目: 来源: 题型:
查看答案和解析>>【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
相关试题

