【题目】某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验。

(1)装置A制取氯气,该反应的化学方程式:___________。
(2)装置C中发生复分解反应制取SO2,该反应的化学方程式:___________。
(3)为验证SO2和Cl2发生了反应,小组同学又继续如下实验。
①甲同学认为若SO2和Cl2反应,生成了Cl-,只要检验到生成的Cl-即可,甲取适量B中样品于试管中,向其中滴加少量___________溶液,有白色沉淀生成。
②乙同学认为甲同学的结论不合理,认为应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法实验即可得到正确结论。洗气瓶中盛有试剂的名称是___________。
③丙同学认为按乙同学的建议改进实验也不合理,理由是:___________。
④丙同学取溶液X于试管中,加入少量反应后B中的溶液,生成大量白色沉淀,得出正确结论:SO2与Cl2同时通入水中,可以发生反应。溶液X是_________(填选项序号)。
a. BaCl2溶液 b. Ba(OH)2溶液 c. 氯水 d. 石蕊溶液
SO2与Cl2同时通入水中反应的化学方程式是______________________。
参考答案:
【答案】2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O Na2SO3+H2SO4=Na2SO4+SO2↑+H2O AgNO3 饱和食盐水 Cl2和水反应也会生成Cl- a SO2+Cl2+2H2O=2HCl+H2SO4
【解析】
(1)在装置A高锰酸钾与浓盐酸发生氧化还原反应产生氯气,该反应的化学方程式是2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;
(2)在装置C浓硫酸与Na2SO3发生复分解反应产生SO2,该反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(3) ①在B中SO2与Cl2会发生反应:SO2+Cl2+2H2O=2HCl+H2SO4,反应后的溶液中含Cl-,可利用AgNO3既不溶于水,也不溶于HNO3的性质检验Cl-。甲中含有Cl-可通过向该溶液中加入硝酸酸化的AgNO3溶液,若反应产生白色沉淀,就证明含有Cl-,所以加入的溶液为AgNO3;
②制备氯气中含有氯化氢和水蒸气,氯化氢进入B中溶于水也会生成氯离子,乙同学认为Cl2中混有的杂质是HCl,需要在A、B间增加一个洗气瓶,用饱和食盐水除去;
③丙同学认为按乙同学的建议改进实验也不合理,理由是Cl2和水反应也会生成Cl-;
④SO2被Cl2氧化为H2SO4,结合硫酸根离子检验证明二氧化硫和氯气发生了反应,丙同学取适量B中溶液于试管中,向其中滴加少量溶液X中含Ba2+,且不能和二氧化硫发生反应,
a.BaCl2溶液可以检验SO42-存在,证明SO2和Cl2发生了反应,a正确;
b.Ba(OH)2和SO2反应生成BaSO3沉淀,不能说明SO2和Cl2发生反应,b错误;
c.氯水有氧化性,氯水能将SO2在溶液中被氧化为H2SO4,也会生成BaSO4沉淀,不能说明说明SO2和Cl2发生反应,c错误;
d.无论氯气与SO2是否发生反应,二者溶于水后的溶液显酸性,酸溶液能够使石蕊溶液变红色,所以不能确定SO2与Cl2是否反应,d错误;
故合理选项是a;
SO2与Cl2同时通入水中反应的化学方程式是:SO2+Cl2+2H2O=2HCl+H2SO4。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:

下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了探究过氧化钠的强氧化性,某小组设计了如图所示的实验装置。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,A中剧烈反应,有黄绿色气体产生。
③待产生连续气泡后,将装置D中的导管末端伸入集气瓶中,收集到无色气体。
④反应一段时间后,关闭分液漏斗的活塞,再通一段时间N2,直至装置中气体变为无色。
回答下列问题:
(1)装置D中收集的无色气体能使带火星的木条复燃,据此推断该气体是_______,解释产生该气体的原因是(用化学方程式表示)____________________________。
(2)装置B中湿润的淀粉碘化钾试纸变蓝。甲同学根据A中气体的颜色推测试纸变蓝时发生的反应可能是(写离子方程式)____________________________;乙同学认为使试纸变蓝的原因也可能是____________________________。
(3)资料显示,Na2O2与干燥的HCl能发生化学反应生成Cl2,该反应的化学方程式为:_________________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】一定条件下,物质的量均为0.3mol的X(g)与Y(g)在容积固定的密闭容器中发生反应:X(g)+3Y(g)
 2Z(g),ΔH=-akJ/mol,下列说法正确的是
2Z(g),ΔH=-akJ/mol,下列说法正确的是A. 反应一段时间后,X与Y的物质的量之比仍为1:1
B. 达到平衡时,反应放出0.1akJ的热量
C. 达到平衡后,若向平衡体系中充入稀有气体,Z的正反应速率将不发生变化
D. X的体积分数保持不变,说明反应已达到平衡
-
科目: 来源: 题型:
查看答案和解析>>【题目】四种短周期主族元素 X、Y、Z、W 的相对位置如表,元素 X 的原子核外电子数是 Z的 2 倍。下列说法不正确的是
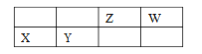
A. W 元素的简单气态氢化物的热稳定性比 Z 元素的简 单气态氢化物的高
B. 气体分子(ZW)2 的结构式为 N≡C—C≡N
C. X、Y、W 三种元素的简单离子半径最大的是 Y
D. 元素 X 位于周期表中第三周期、第ⅡA族,其单质制备可用电解熔融 XCl2 的方法。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、D是生活中常见的金属单质,B、C、E、F、G、H是中学常见的6种化合物,反应①可用于焊接钢轨,相关物质间的关系如下图所示。

(1)H的化学式是______________。
(2)反应①的化学方程式是____________________________。
(3)反应②的离子方程式是____________________________。
(4)检验F溶液中金属阳离子的操作和现象是____________________________。
(5)H转化为G的实验现象是__________________________________________。
(6)为了更清楚地观察到生成H的现象,使F的溶液与NaOH溶液反应的正确操作是_______(填下图字母)

-
科目: 来源: 题型:
查看答案和解析>>【题目】等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应,若生成硫酸钡沉淀的质量比为1∶2∶3,则三种硫酸盐的物质的量浓度之比为( )
A. 1∶2∶3 B. 1∶6∶9 C. 1∶3∶3 D. 1∶3∶6
相关试题

