【题目】下列说法正确的是( )
A. 新发现的核素![]() 中,电子数比中子数多179
中,电子数比中子数多179
B. 白磷和红磷互为同分异构体
C. 氕、氘、氚互为同素异形体
D. CH3CH2CH2CH3 和C(CH3)4互为同系物
参考答案:
【答案】D
【解析】A.质子数+中子数=质量数,质子数=核外电子数;
B.分子式相同结构不同的化合物互为同分异构体;
C.由同一种元素形成的不同单质互为同素异形体;
D.结构相似,分子组成上相差若干个CH2原子团的有机物,互为同系物。
A. 新发现的核素![]() 中,电子数为118,中子数297-118=179,电子数比中子数少179-118=61个,A错误;
中,电子数为118,中子数297-118=179,电子数比中子数少179-118=61个,A错误;
B. 白磷和红磷均为磷元素的单质,属于同素异形体,B错误;
C. 氕、氘、氚的质子数相同,中子数不同,互为同位素,C错误;
D. CH3CH2CH2CH3和C(CH3)4的结构相似,分子组成上相差1个CH2原子团,互为同系物,D正确;
答案选D。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某温度时,在2L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。
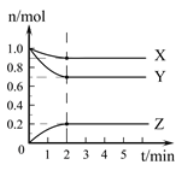
(1)反应开始至2 mim,Y的平均反应速率_________。
(2)分析有关数据,写出X、Y、Z的反应方程式______________________________。
(3)当反应进行了3 min,该反应是否达到平衡___________(填“是”或“否”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
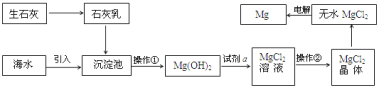
提示: ①MgCl2晶体的化学式为MgCl26H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(1)操作①的名称是 ________, 操作②的名称___________、冷却结晶、过滤。
(2)试剂a的名称是_____________。
(3)用氯化镁电解生产金属镁的化学方程式为:_____________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知pC=-lgc;Ksp[Cu(OH)2]=2.2×10-20和Ksp[Mg(OH)2]=1.8×10-11,测得两种金属离子的PC与pH的变化关系如下图所示。下列说法正确的是

A. 加入氨水调节pH可除去MgS04溶液中的CuSO4杂质
B. pH调到Q点则Mg2+和Cu2+都已沉淀完全
C. 在浓度均为1mo/LCuSO4和MgS04的混合溶液中,存在c(Cu2+)+c(Mg2+)>c(S042-)
D. L1代表pC(Cu2+)随pH变化,L2代表pC(Mg2+)随pH变化
-
科目: 来源: 题型:
查看答案和解析>>【题目】某冶金厂的炉渣中主要成分为CuO、Cu、Ag、Bi、Pb,还含有少量的SiO2和Au,从炉渣中回收有价金属的一种工艺流程如下:
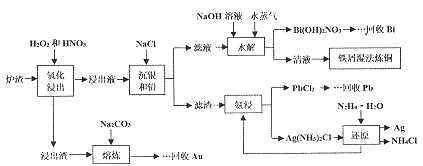
回答下列问题:
(1)加快“氧化浸出”速率的措施有________________。 (写出两种)。
(2)加入NaOH溶液的目的是调节滤液的pH,水解时通入水蒸气的目的是________。
(3)温法炼铜后溶液中主要的物质有(写化学式)____________。
(4)氨浸实验时,需要在常温下进行的原因是_________;熔炼时加入Na2CO3的目的是除硅,写出反应方程式____________。
(5)沉银和铅时,已知Ksp(AgCl)=1.8×10-10,Ksp(PbCl2)=1.8×10-5,当AgCl和PbCl2共沉且c(Pb2+):c(Ag+)=103时,溶液中的c(C1-)=______mol/L。
(6)写出流程中还原制银的化学方程式____________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列叙述正确的是 ( )
A. 950C纯水的pH<7,说明加热可导致水呈酸性
B. pH=3的醋酸溶液,稀释至10倍后pH=4
C. 用pH相等的盐酸、醋酸分别中和等体积等浓度的NaOH溶液,消耗两种酸的体积大小关系是:V(盐酸)>V(醋酸)
D. 室温下pH=3的醋酸溶液与pH=11的醋酸钠溶液中水电离出的c(H+)相等
-
科目: 来源: 题型:
查看答案和解析>>【题目】丙烯是一种重要的石油化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义,其中一种工艺原理如下:
①C3H8(g)
 C3H6(g)+H2(g)△H1
C3H6(g)+H2(g)△H1②C3H8(g)
 C2H4(g)+CH4(g) △H2=+81.7kJ/mol
C2H4(g)+CH4(g) △H2=+81.7kJ/mol③C2H4(g)+H2(g)
 C2H6(g) △H3
C2H6(g) △H3④C3H8(g) +H2(g)
 CH4(g)+C2H6(g) △H4=-54.8kJ/mol
CH4(g)+C2H6(g) △H4=-54.8kJ/mol(1)计算反应③的反应热△H3=______________。
(2)丙烷脱氢平衡常数、丙烷裂解产物选择性与温度关系如图1所示,从图像判断△H2____0,工业生产中采用的温度600-650℃,原因是__________________。
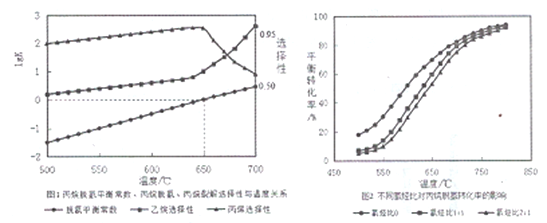
(3)温度为650℃时,在1L的容器中投入1molC3H8和1molH2发生反应①,计算该条件下C3H8理论脱氢率为(保留3位有效数字,下同)_________________(已知:
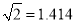 )
)(4)不同氢烃比和温度对丙院脱氢平衡转化率的影响如上图2所示。相同温度下,增大氢烃比平衡转化率下降的原因是__________________。
(5)丙烯经过两步氧化可制得丙烯酸(用HR表示,其电离常数Ka=5.55×10-5)。常温下,丙烯酸钠的水解常数为________,将0.2mol/LHR与0.1mol/LNaOH等体积混合,则溶液中的离子浓度大小顺序为__________________。
相关试题

