【题目】下列叙述正确的是 ( )
A. 950C纯水的pH<7,说明加热可导致水呈酸性
B. pH=3的醋酸溶液,稀释至10倍后pH=4
C. 用pH相等的盐酸、醋酸分别中和等体积等浓度的NaOH溶液,消耗两种酸的体积大小关系是:V(盐酸)>V(醋酸)
D. 室温下pH=3的醋酸溶液与pH=11的醋酸钠溶液中水电离出的c(H+)相等
参考答案:
【答案】C
【解析】A.因室温纯水的pH=7,水的电离过程(H2O![]() H+ +OH- )是吸热反应,升高到95℃,电离度增大,使c(H+)= c(OH-)>10 -7 mol/L,则pH<7,但水电离出的氢离子和氢氧根离子相等,所以水仍是中性,选项A错误;B.由于CH3COOH溶液中存在:CH3COOH
H+ +OH- )是吸热反应,升高到95℃,电离度增大,使c(H+)= c(OH-)>10 -7 mol/L,则pH<7,但水电离出的氢离子和氢氧根离子相等,所以水仍是中性,选项A错误;B.由于CH3COOH溶液中存在:CH3COOH![]() CH3COO- +H+ ,所以将pH=3的CH3COOH溶液加水稀释10倍,促进弱电解质电离,pH<4,选项B错误;C.pH相等的盐酸、醋酸,醋酸的浓度大于氢离子浓度,盐酸的浓度等于氢离子浓度,所以醋酸的浓度大于盐酸的浓度,因此,消耗两种酸的体积大小关系是:V(盐酸)>V(醋酸),选项C正确;D.醋酸电离出氢离子抑制水的电离,醋酸钠水解促进水的电离,所以醋酸钠中水电离出的氢离子浓度大于醋酸溶液中水电离的氢离子浓度,选项D错误。答案选C。
CH3COO- +H+ ,所以将pH=3的CH3COOH溶液加水稀释10倍,促进弱电解质电离,pH<4,选项B错误;C.pH相等的盐酸、醋酸,醋酸的浓度大于氢离子浓度,盐酸的浓度等于氢离子浓度,所以醋酸的浓度大于盐酸的浓度,因此,消耗两种酸的体积大小关系是:V(盐酸)>V(醋酸),选项C正确;D.醋酸电离出氢离子抑制水的电离,醋酸钠水解促进水的电离,所以醋酸钠中水电离出的氢离子浓度大于醋酸溶液中水电离的氢离子浓度,选项D错误。答案选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知pC=-lgc;Ksp[Cu(OH)2]=2.2×10-20和Ksp[Mg(OH)2]=1.8×10-11,测得两种金属离子的PC与pH的变化关系如下图所示。下列说法正确的是

A. 加入氨水调节pH可除去MgS04溶液中的CuSO4杂质
B. pH调到Q点则Mg2+和Cu2+都已沉淀完全
C. 在浓度均为1mo/LCuSO4和MgS04的混合溶液中,存在c(Cu2+)+c(Mg2+)>c(S042-)
D. L1代表pC(Cu2+)随pH变化,L2代表pC(Mg2+)随pH变化
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法正确的是( )
A. 新发现的核素
 中,电子数比中子数多179
中,电子数比中子数多179B. 白磷和红磷互为同分异构体
C. 氕、氘、氚互为同素异形体
D. CH3CH2CH2CH3 和C(CH3)4互为同系物
-
科目: 来源: 题型:
查看答案和解析>>【题目】某冶金厂的炉渣中主要成分为CuO、Cu、Ag、Bi、Pb,还含有少量的SiO2和Au,从炉渣中回收有价金属的一种工艺流程如下:
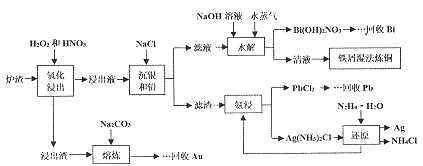
回答下列问题:
(1)加快“氧化浸出”速率的措施有________________。 (写出两种)。
(2)加入NaOH溶液的目的是调节滤液的pH,水解时通入水蒸气的目的是________。
(3)温法炼铜后溶液中主要的物质有(写化学式)____________。
(4)氨浸实验时,需要在常温下进行的原因是_________;熔炼时加入Na2CO3的目的是除硅,写出反应方程式____________。
(5)沉银和铅时,已知Ksp(AgCl)=1.8×10-10,Ksp(PbCl2)=1.8×10-5,当AgCl和PbCl2共沉且c(Pb2+):c(Ag+)=103时,溶液中的c(C1-)=______mol/L。
(6)写出流程中还原制银的化学方程式____________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】丙烯是一种重要的石油化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义,其中一种工艺原理如下:
①C3H8(g)
 C3H6(g)+H2(g)△H1
C3H6(g)+H2(g)△H1②C3H8(g)
 C2H4(g)+CH4(g) △H2=+81.7kJ/mol
C2H4(g)+CH4(g) △H2=+81.7kJ/mol③C2H4(g)+H2(g)
 C2H6(g) △H3
C2H6(g) △H3④C3H8(g) +H2(g)
 CH4(g)+C2H6(g) △H4=-54.8kJ/mol
CH4(g)+C2H6(g) △H4=-54.8kJ/mol(1)计算反应③的反应热△H3=______________。
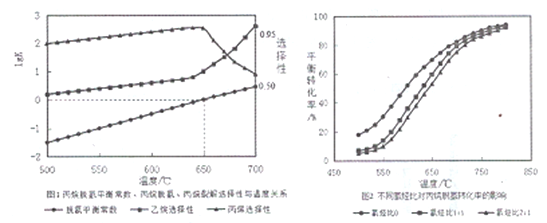
(2)丙烷脱氢平衡常数、丙烷裂解产物选择性与温度关系如图1所示,从图像判断△H2____0,工业生产中采用的温度600-650℃,原因是__________________。
(3)温度为650℃时,在1L的容器中投入1molC3H8和1molH2发生反应①,计算该条件下C3H8理论脱氢率为(保留3位有效数字,下同)_________________(已知:
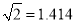 )
)(4)不同氢烃比和温度对丙院脱氢平衡转化率的影响如上图2所示。相同温度下,增大氢烃比平衡转化率下降的原因是__________________。
(5)丙烯经过两步氧化可制得丙烯酸(用HR表示,其电离常数Ka=5.55×10-5)。常温下,丙烯酸钠的水解常数为________,将0.2mol/LHR与0.1mol/LNaOH等体积混合,则溶液中的离子浓度大小顺序为__________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质不能通过化合反应制得的是( )
A. Fe(OH)3 B. Fe(OH)2 C. CaSiO3 D. FeCl3
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)已知在一定温度下,以下三个反应的平衡常数分别为K1、K2、K3:
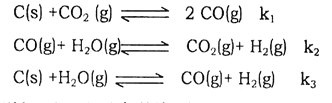
则K1、K2、K3之间的关系是K3=__________________
(2)25℃时将pH=3的强酸与pH=12的强碱溶液混合,所得溶液pH=10,则强酸与强碱的体积比是(溶液混合时体积变化忽略不计)________________
相关试题

