【题目】硝酸钾溶液在火焰上灼烧时,隔着蓝色钴玻璃可观察到火焰呈现的颜色为
A.紫色B.黄色C.绿色D.红色
参考答案:
【答案】A
【解析】
只有某些金属元素才有焰色反应,如钾元素的焰色反应为紫色,焰色反应是元素的性质,只要含有钾元素,则焰色反应即为紫色,但钾元素的紫色需要透过蓝色钴玻璃滤去火焰的黄光才能看到;答案选A。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列离子方程式中,书写正确的是( )。
A.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.稀硫酸与氢氧化钡溶液反应:Ba2++H++OH-+
 =H2O+BaSO4↓
=H2O+BaSO4↓C.碳酸钙与稀盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
D.铜片跟硝酸银溶液反应:Cu+Ag+=Cu2++Ag
-
科目: 来源: 题型:
查看答案和解析>>【题目】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质
SiCl4
BCl3
AlCl3
FeCl3
PCl5
沸点/℃
57.7
12.8
-
315
-
熔点/℃
-70.0
-107.2
-
-
-
升华温度/℃
-
-
180
300
162
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:______________________________。
(2)装置F的名称是___________________;装置C中的试剂是_____________;装置E中的h瓶需要冷却的理由是_____________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是____(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式为5Fe2++MnO4-+8H+==5Fe3++Mn2++4H2O。
①滴定前是否要滴加指示剂?________(填“是”或“否”)。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol· L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是_____________
-
科目: 来源: 题型:
查看答案和解析>>【题目】“常见无机物”,主要是指的铝、铁、硫、氯四种元素的单质及化合物。完成下列填空:
(1)四种元素原子的半径大小 Fe> > > 。_________
(2)铝原子最外层电子排布式为_____,核外共有_____种不同运动状态的电子。
(3)实验室制备氯化氢气体的反应:_____。其制备装置和实验室制备_气体类似(填化学式)。
(4)16g 硫磺在过量氧气中燃烧放出 149kJ 的热量,写出该热化学方程式______________。
(5)比较两种化合物熔点高低,氯化钠_____氧化镁,请解释原因:______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列反应中,铁元素被氧化的是
A. FeS+2HCl=FeCl2+H2S↑ B. Fe+H2S04=FeS04+H2↑
C. FeO+2HCl=FeCl2+H20 D. Fe203+3CO
 2Fe+3C02
2Fe+3C02 -
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法中正确的是
A.将纯水加热的过程中,Kw变大,pH变小
B.保存FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1 molL-1氨水中加入少量水,pH减小,
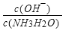 减小
减小 -
科目: 来源: 题型:
查看答案和解析>>【题目】分别向含有下列离子的溶液中加入少量SO3固体后,原溶液中离子的数目不变的是(提示:SO3+H2O=H2SO4)( )。
A.Mg2+B.
 C.Ba2+D.OH-
C.Ba2+D.OH-
相关试题

