【题目】“常见无机物”,主要是指的铝、铁、硫、氯四种元素的单质及化合物。完成下列填空:
(1)四种元素原子的半径大小 Fe> > > 。_________
(2)铝原子最外层电子排布式为_____,核外共有_____种不同运动状态的电子。
(3)实验室制备氯化氢气体的反应:_____。其制备装置和实验室制备_气体类似(填化学式)。
(4)16g 硫磺在过量氧气中燃烧放出 149kJ 的热量,写出该热化学方程式______________。
(5)比较两种化合物熔点高低,氯化钠_____氧化镁,请解释原因:______________。
参考答案:
【答案】Al>S>Cl 3s23p1 13 NaCl(s)+H2SO4(浓) ![]() NaHSO4+HCl↑ Cl2 S(s)+O2(g)=SO2(g) H=-298kJ/mol 小于 NaCl 和 MgO 均为离子晶体,离子键作用越强其熔点越高,离子键作用力与离子所带电荷成 正比,与离子半径成反比,O2-与 Mg2+所带电荷比 Na+和 Cl-多,O2-半径小于 Cl-半径,Mg2+半径小于 Na+半径
NaHSO4+HCl↑ Cl2 S(s)+O2(g)=SO2(g) H=-298kJ/mol 小于 NaCl 和 MgO 均为离子晶体,离子键作用越强其熔点越高,离子键作用力与离子所带电荷成 正比,与离子半径成反比,O2-与 Mg2+所带电荷比 Na+和 Cl-多,O2-半径小于 Cl-半径,Mg2+半径小于 Na+半径
【解析】
(1)电子层数越多,半径越大;电子层数相同时,核电荷数越多,半径越小;据此进行分析;
(2)铝原子核外有13个电子,基态原子核外电子排布式为1s22s22p63s23p1,据此分析原子最外层电子排布式规律及核外电子运动状态的种类;
(3)实验室制备氯化氢气体,采用的是加热固体氯化钠和浓硫酸的方法,采用的是固液加热型装置;
(4)根据16g(即0.5mol)固体硫与氧气发生燃烧反应生成二氧化硫气体,放出149 kJ 的热量,从而计算出1mol固体硫完全燃烧放出的热量,据此写出硫燃烧的热化学方程式;
(5)离子晶体中,离子键作用越强其熔点越高,离子键作用力与离子所带电荷成正比,与离子半径成反比,据此进行分析。
(1)电子层数越多,半径越大;电子层数相同时,核电荷数越多,半径越小;铁有四个电子层,Al、S、Cl均为三个电子层,所以半径大小为:Fe>Al>S>Cl;
故答案是:Al>S>Cl;
(2)铝原子核外有13个电子,根据构造原理书写其基态原子核外电子排布式为1s22s22p63s23p1,则最外层电子排布式为3s23p1;核外共有13种不同运动状态的电子;
故答案是:3s23p1;13;
(3)实验室制备氯化氢气体,采用的是加热固体氯化钠和浓硫酸的方法,其化学方程式为NaCl(s)+H2SO4(浓) ![]() NaHSO4+HCl↑ ,采用的是固液加热型装置,与实验室制备氯气装置类似;
NaHSO4+HCl↑ ,采用的是固液加热型装置,与实验室制备氯气装置类似;
故答案是:NaCl(s)+H2SO4(浓) ![]() NaHSO4+HCl↑;Cl2;
NaHSO4+HCl↑;Cl2;
(4)16g硫物质的量为0.5mol,0.5mol固体硫与氧气发生燃烧反应生成二氧化硫气体,放出149 kJ 的热量,1mol固体硫与氧气发生燃烧反应生成二氧化硫气体,放出149 kJ ÷0.5=298 kJ 的热量,该热化学方程式为S(s)+O2(g)=SO2(g) H=-298kJ/mol;
故答案是:S(s)+O2(g)=SO2(g) H=-298kJ/mol;
(5)熔点NaCl 小于MgO ;NaCl 和MgO均为离子晶体,离子键作用越强其熔点越高,离子键作用力与离子所带电荷成正比,与离子半径成反比,O2-与Mg2+所带电荷比Na+和Cl-多,O2-半径小于Cl-半径,Mg2+半径小于Na+半径;
故答案是:小于; NaCl 和 MgO 均为离子晶体,离子键作用越强其熔点越高,离子键作用力与离子所带电荷成正比,与离子半径成反比,O2-与 Mg2+所带电荷比 Na+和 Cl-多,O2-半径小于 Cl-半径,Mg2+半径小于 Na+半径。
-
科目: 来源: 题型:
查看答案和解析>>【题目】碳及其化合物的转化关系:C
 CO2
CO2 H2CO3
H2CO3 CaCO3
CaCO3 CO2,其中涉及的基本反应类型依次是( )。
CO2,其中涉及的基本反应类型依次是( )。A.化合、置换、分解、复分解
B.置换、复分解、化合、分解
C.置换、化合、复分解、分解
D.置换、化合、分解、复分解
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列离子方程式中,书写正确的是( )。
A.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.稀硫酸与氢氧化钡溶液反应:Ba2++H++OH-+
 =H2O+BaSO4↓
=H2O+BaSO4↓C.碳酸钙与稀盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
D.铜片跟硝酸银溶液反应:Cu+Ag+=Cu2++Ag
-
科目: 来源: 题型:
查看答案和解析>>【题目】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质
SiCl4
BCl3
AlCl3
FeCl3
PCl5
沸点/℃
57.7
12.8
-
315
-
熔点/℃
-70.0
-107.2
-
-
-
升华温度/℃
-
-
180
300
162
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:______________________________。
(2)装置F的名称是___________________;装置C中的试剂是_____________;装置E中的h瓶需要冷却的理由是_____________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是____(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式为5Fe2++MnO4-+8H+==5Fe3++Mn2++4H2O。
①滴定前是否要滴加指示剂?________(填“是”或“否”)。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol· L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是_____________
-
科目: 来源: 题型:
查看答案和解析>>【题目】硝酸钾溶液在火焰上灼烧时,隔着蓝色钴玻璃可观察到火焰呈现的颜色为
A.紫色B.黄色C.绿色D.红色
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列反应中,铁元素被氧化的是
A. FeS+2HCl=FeCl2+H2S↑ B. Fe+H2S04=FeS04+H2↑
C. FeO+2HCl=FeCl2+H20 D. Fe203+3CO
 2Fe+3C02
2Fe+3C02 -
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法中正确的是
A.将纯水加热的过程中,Kw变大,pH变小
B.保存FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1 molL-1氨水中加入少量水,pH减小,
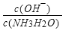 减小
减小
相关试题

