【题目】把6.5gZn放入足量的稀盐酸中,锌完全反应.计算
(1)参加反应的HCl的物质的量.
(2)生成氢气的体积(标准状况).
参考答案:
【答案】
(1)解:锌和稀盐酸反应生成氯化锌和氢气,反应发生为 Zn+2HCl=ZnCl2+H2↑;参加反应的n(HCl)=2n(Zn)=2× ![]() =0.2mol,
=0.2mol,
答:参加反应的稀盐酸的物质的量是0.2mol
(2)解:锌和稀盐酸反应生成氯化锌和氢气,反应发生为 Zn+2HCl=ZnCl2+H2↑;参加反应的n(HCl)=0.2mol,生成氢气的物质的量是0.1mol,
体积V=nVm=0.1mol×22.4L/mol=2.24L,
答:生成氢气体积是2.24L
【解析】(1)根据锌和稀盐酸关系式计算参加反应的HCl的物质的量;(2)根据化学方程式计算生成氢气体积.
-
科目: 来源: 题型:
查看答案和解析>>【题目】某有机物的结构简式如图,则此有机物可发生的反应类型有( ) ①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦中和.
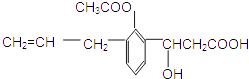
A.①②③⑤⑥
B.②③④⑤⑥
C.①②③④⑤⑥
D.全部正确 -
科目: 来源: 题型:
查看答案和解析>>【题目】某兴趣小组探究SO2气体还原Fe3+、I2 , 他们使用的药品和装置如下图所示:

(1)SO2气体还原Fe3+生成的还原产物是(填离子符号),参加反应的SO2 和Fe3+的物质的量之比是 .
(2)下列实验方案适用于在实验室制取所需SO2的是(双选,填序号).
A.Na2SO3溶液与HNO3
B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧
D.铜与热浓H2SO4
(3)装置C的作用是 .
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有(双选,填序号).A蒸发皿 B 石棉网 C 漏斗 D 烧杯 E 玻璃棒 F 坩埚
(5)在上述装置中通入过量的SO2 , 为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第三份试液加入用稀盐酸酸化的BaCl2 , 产生白色沉淀.
上述方案不合理的一个是 , 原因是 .
(6)上述装置中能表明I﹣的还原性弱于SO2的现象是 . -
科目: 来源: 题型:
查看答案和解析>>【题目】胶体区别于溶液最本质的特征是( )
A. 分散质粒子的直径大小 B. 有丁达尔效应
C. 分散质粒子因吸附而带电荷 D. 可以通过滤纸
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列条件的改变,一定能加快化学反应速率的是( )
A.增大压强
B.升高温度
C.增大反应物的量
D.减小生成物的浓度 -
科目: 来源: 题型:
查看答案和解析>>【题目】金属也能够导电,金属是电解质么?电解质溶液导电和金属导电有何不同?
_______________________,_____________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
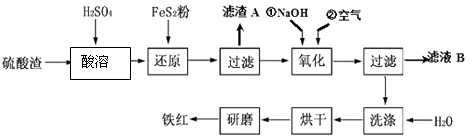
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为;“滤渣A”主要成份的化学式为 .
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+ , 而本身被氧化为H2SO4 , 请完成该反应的离子方程式:FeS2+14Fe3++H2O═15Fe2++SO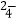 + .
+ .
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 .
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是(几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式) .沉淀物
Fe(OH)3
Al(OH)3
Fe(OH)2
Mg(OH)2
开始沉淀pH
2.7
3.8
7.6
9.4
完全沉淀pH
3.2
5.2
9.7
12.4
相关试题

