
【题目】钨是重要的战略物资,2016年我国江西省发现超大型钨矿,再次刷新钨矿储量的世界纪录。由钨铁矿(主要成分是![]() ,还含有少量
,还含有少量![]() )制取钨的工业流程如下(已知:常温下,钨酸难溶于水)。
)制取钨的工业流程如下(已知:常温下,钨酸难溶于水)。
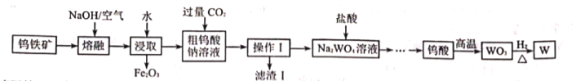
请回答下列有关问题:
(1)浸取后进行的分离操作的名称是________。
(2)滤渣![]() 的主要成分是________(填化学式),写出生成该物质的离子方程式________。
的主要成分是________(填化学式),写出生成该物质的离子方程式________。
(3)已知![]() 中铁元素的化合价为+2价,
中铁元素的化合价为+2价,![]() 在熔融过程中发生反应的化学方程式为________。
在熔融过程中发生反应的化学方程式为________。
(4)在![]() 溶液中加入盐酸时,为了防止局部酸度过大,应采取的措施是________。
溶液中加入盐酸时,为了防止局部酸度过大,应采取的措施是________。
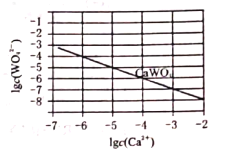
(5)如图为![]() 在常温下的沉淀溶解平衡曲线,若将
在常温下的沉淀溶解平衡曲线,若将![]() 的
的![]() 溶液与
溶液与![]() 的
的![]() 溶液按体积比2:1混合,要产生
溶液按体积比2:1混合,要产生![]() 沉淀,则
沉淀,则![]() ________。(忽略溶液体积变化)
________。(忽略溶液体积变化)
(6)用碳化钨![]() 作阳极,不锈钢作阴极,
作阳极,不锈钢作阴极,![]() 溶液作电解液,通过电解可以回收钨,电解后阳极上析出钨酸并放出
溶液作电解液,通过电解可以回收钨,电解后阳极上析出钨酸并放出![]() ,则阳极反应式为________;若在标准状况下放出
,则阳极反应式为________;若在标准状况下放出![]() ,则阳极增重的质量为________
,则阳极增重的质量为________![]() 。
。
【答案】过滤 ![]()
![]()
 分次缓慢加入盐酸, 并不断搅拌
分次缓慢加入盐酸, 并不断搅拌 ![]()
![]() 40.5
40.5
【解析】
由流程可知,钨酸亚铁和氢氧化钠、氧气反应生成氧化铁和钨酸钠,Al2O3和氢氧化钠反应生成NaAlO2和水,水浸时,氧化铁不溶于水,钨酸钠溶于水,故过滤后得到的滤液含钨酸钠和NaAlO2,滤渣的主要成份是Fe2O3,滤液中通入CO2后与NaAlO2反应生成Al(OH)3沉淀和碳酸氢钠,经过操作Ⅰ得到钨酸钠溶液和滤渣Ⅰ,故操作Ⅰ是过滤,滤液再和浓盐酸反应生成钨酸和氯化钠;加热钨酸分解产生三氧化钨和水,用还原剂还原三氧化钨生成钨,据此再进行解题。
(1)由分析可知,浸取后进行的分离得到Fe2O3和溶液,故该分离操作的名称是过滤,故答案为:过滤;
(2)经过分析,通入CO2主要发生反应为:NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3,故滤渣![]() 的主要成分是Al(OH)3,生成该物质的离子方程式
的主要成分是Al(OH)3,生成该物质的离子方程式![]() ,故答案为:Al(OH)3;
,故答案为:Al(OH)3;![]() ;
;
(3)根据流程图可知,FeWO4在熔融过程中得反应物是FeWO4、NaOH和O2,生成物有Na2WO4、Fe2O3等,加上FeWO4中铁元素的化合价为+2价,故该反应为氧化还原反应,故发生反应的化学方程式为: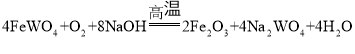 ,故答案为:
,故答案为: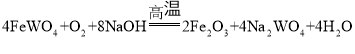 ;
;
(4)在Na2WO4溶液中加入盐酸时,为了防止局部酸度过大,就是让Na2WO4和盐酸能够及时完全反应,故应采取的措施是分次缓慢加入盐酸, 并不断搅拌,故答案为:分次缓慢加入盐酸, 并不断搅拌;
(5)从CaWO4在常温下的沉淀溶解平衡曲线可知,![]() ,若将
,若将![]() 的Na2WO4溶液与1×10-4mol/L的CaCl2溶液按体积比2:1混合后溶液中c(Ca2+)=
的Na2WO4溶液与1×10-4mol/L的CaCl2溶液按体积比2:1混合后溶液中c(Ca2+)=![]() ,要产生CaWO4沉淀则c(Ca2+)c(
,要产生CaWO4沉淀则c(Ca2+)c(![]() )≥
)≥![]() ,即
,即![]() ,解得
,解得![]()
![]() ,故答案为:
,故答案为:![]() ;
;
(6)![]() 作阳极, 阳极发生氧化反应,且在阳极上析出钨酸并放出
作阳极, 阳极发生氧化反应,且在阳极上析出钨酸并放出![]() , 故阳极反应式为:
, 故阳极反应式为:![]() ,标准状况下生成
,标准状况下生成![]() ,参与反应的
,参与反应的 ![]() 为
为![]() , 阳极由
, 阳极由 ![]() 转化为
转化为![]() , 增重的质量为:
, 增重的质量为: ![]() ,故答案为:
,故答案为:![]() ;40.5。
;40.5。


科目:高中化学 来源: 题型:
【题目】化学研究小组探究外界条件对化学反应mA(g)+nB(g)![]() pC(g)+qD(g)的速率和平衡的影响图像如下,下列判断错误的是( )
pC(g)+qD(g)的速率和平衡的影响图像如下,下列判断错误的是( )
A.甲图中,表示反应速率v正>v逆的是点1
B.乙图中,若m+n=p+q,则a曲线可能使用了催化剂
C.由丙图可知,T1<T2,该反应正反应为放热反应
D.由丁图可知,该反应m+n>p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
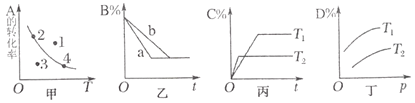
【题目】三室式电渗析法处理含乳酸(HA表示乳酸分子,A-表示乳酸根离子)废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,下列说法正确的是( )
A.阴极区电极反应式为4OH--4e-=2H2O+O2↑
B.交换膜cd为阳离子交换膜,H+从阳极区通过阳离子交换膜进入浓缩室
C.通电一段时间后浓缩室水的量减少,导致乳酸溶液增大
D.当电路中通过1mol电子的电量时,两极一定共产生11.2L(标准状况下)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
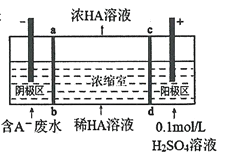
【题目】我国科学家研发的对二甲苯合成流程如图所示。下列说法正确的是( )
A.过程Ⅰ发生的是取代反应
B.可用溴水鉴别![]() 和对二甲苯
和对二甲苯
C.对二甲苯的密度比水大
D.![]() 的某种同分异构体含有苯环且能与钠反应放出氢气
的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】拉曼光谱证实,![]() 在水中转化为[Al(OH)4]-。将一定量的Na2CO3、NaAlO2固体混合物溶于适量水中,再逐滴加入1mol/L盐酸,测得溶液中
在水中转化为[Al(OH)4]-。将一定量的Na2CO3、NaAlO2固体混合物溶于适量水中,再逐滴加入1mol/L盐酸,测得溶液中![]() 、
、![]() 、[Al(OH)4]-、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是
、[Al(OH)4]-、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是
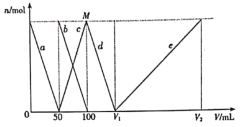
A.![]() 、
、![]() 和[Al(OH)4]-在水溶液中可大量共存
和[Al(OH)4]-在水溶液中可大量共存
B.d线表示的反应为:[Al(OH)4]-+H+=Al(OH)3↓+H2O
C.原固体混合物中![]() 与
与![]() 的物质的量之比为1:1
的物质的量之比为1:1
D.V1=150mL,V2=300mL;M点生成的CO2为0.05mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸是生活中常见的有机物之一,不仅是食醋的主要成分,在工业上也可用于制氢,已知如下反应:
热裂解反应:![]()
![]()
脱羧基反应:![]()
![]()
合成乙酸反应:![]()
![]()
(1)请写出![]() 与
与![]() 甲醇化的热化学方程式________。
甲醇化的热化学方程式________。
(2)在密闭容器中,利用乙酸制甲烷,若要使甲烷的产率较高,制备时选择的适宜条件为________。
a.较低温度 b.较大压强 c.高温 d.低压
(3)向一恒容密闭容器充入一定量的乙酸气体发生反应,相同时间后,测得温度与气体产率的关系如图:
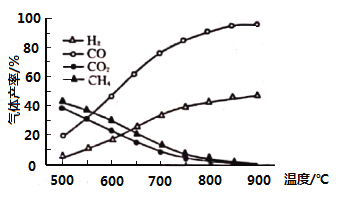
①约![]() 之前氢气产率低于甲烷的可能原因是________。而
之前氢气产率低于甲烷的可能原因是________。而![]() 之后氢气产率高于甲烷的理由是________。
之后氢气产率高于甲烷的理由是________。
②一定温度下,若在充入容器的乙酸气体中掺杂一定量水蒸气,氢气产率显著提高而![]() 产率下降,原因是________(用化学方程式表示)。
产率下降,原因是________(用化学方程式表示)。
(4)温度为![]() 时,在密闭容器中充入一定量乙酸气体,若利用合适的催化剂控制不发生其他的副反应,达到平衡时总压强为
时,在密闭容器中充入一定量乙酸气体,若利用合适的催化剂控制不发生其他的副反应,达到平衡时总压强为![]() ,热裂解反应消耗乙酸
,热裂解反应消耗乙酸![]() ,脱羧基反应消耗乙酸
,脱羧基反应消耗乙酸![]() ,乙酸的体积分数为________;脱羧基反应的平衡常数
,乙酸的体积分数为________;脱羧基反应的平衡常数![]() =________
=________![]() (
(![]() 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(Aspirin,乙酰水杨酸)具有解热止痛,抑制血小板凝聚,防止血栓形成的功效,是家庭中常备药品。水杨酸与乙酸酐反应制取阿司匹林的原理如图:
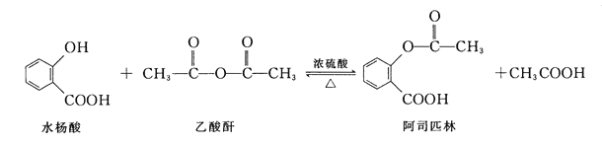
下列有关说法错误的是
A.水杨酸分子中所有原子可能共面
B.水杨酸的同分异构体中,属于苯环上二元取代物的还有5种(不考虑过氧键)
C.乙酰水杨酸在一定条件下能发生加成、水解、酯化等反应
D.分离乙酰水杨酸和乙酸可以加入饱和Na2CO3溶液后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
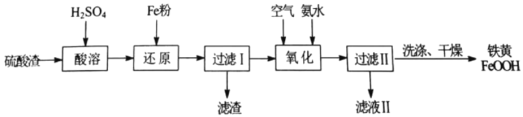
(1)“酸溶”时加快溶解的方法可以是________。(写出一种)
(2)“还原”过程中主要反应的离子方程式为________。
(3)“氧化”过程中,生成FeOOH的离子方程式为________。
(4)“过滤Ⅱ”所得铁黄在洗涤过程中,检验铁黄表面已洗涤干净的操作是________。
(5)实验测得反应溶液的![]() 、温度对铁黄产率的影响如图1、图2所示。
、温度对铁黄产率的影响如图1、图2所示。
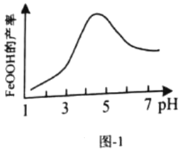
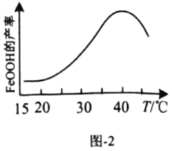
①反应温度宜选择________;
②氧化时应控制pH的合理范围是4.5左右,pH过小或过大均会导致铁黄产率较低,其可能原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室废液含![]() 等离子,现通过如下流程变废为宝制备
等离子,现通过如下流程变废为宝制备![]() 。
。
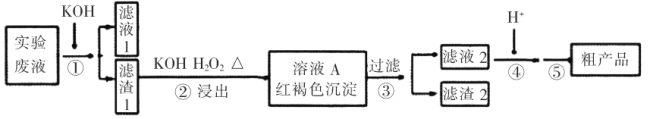
已知:(a)![]()
![]() (黄色)
(黄色)
(b)金属离子形成氢氧化物沉淀的pH范围如表。
金属离子 | pH | |
沉淀 | 沉淀 | |
Fe3+ | 2.7 | 3.7 |
Cr3+ | 4.9 | 6.8 |
请回答:
(1)如在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是:_________________。
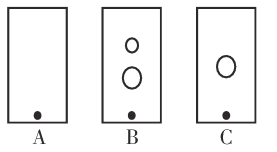
(2)某同学采用纸层析法判断步骤①加入KOH的量是否合适。在加入一定量KOH溶液后,用毛细管取样、点样、薄层色谱展开、氨熏后的点如图所示。加入KOH最适合的实验编号是(上图ABC中选择,实验顺序已乱)_________________,C的斑点颜色为_________________。
(3)步骤②含Cr物质发生的主要反应的离子方程式为_________________。
(4)在下列装置中,步骤②应选用实验装置是_________________。(填标号)
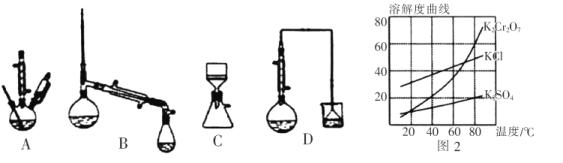
(5)部分物质的溶解度曲线如图2,步骤⑤可能用到下列部分操作:a.蒸发至出现大量晶体,停止加热;b.冷却至室温;c.蒸发至溶液出现晶膜,停止加热;d.洗涤;e.趁热过滤;f.抽滤。请选择合适操作的正确顺序_________________。
(6)步骤⑤中合适的洗涤剂是_________________(“无水乙醇”、“乙醇-水混合液”、“热水”、“冰水”),粗产品进一步提纯的方法是_________________。
(7)取mg粗产品配成250mL溶液,取25.00mL于锥形瓶中,用cmol.L-1的![]() 标准溶液滴定(杂质不反应),消耗标准
标准溶液滴定(杂质不反应),消耗标准![]() 溶液VmL,则该粗产品中
溶液VmL,则该粗产品中![]() 的纯度为_________________。(
的纯度为_________________。(![]() 的式量:294)
的式量:294)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com