【题目】据媒体报道,以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池(PEMFC) 常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是
①正极反应为:O2+4H++4e- ═2H2O
②负极反应为:2H2-4e- ═4H+
③总的化学反应为:2H2+O2![]() 2H2O
2H2O
④H+通过电解质向正极移动
A.①②③④ B.②③④ C.①②④ D.①②③
参考答案:
【答案】A
【解析】
试题分析:该燃料电池属于原电池,①正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4H++4e- ═2H2O,正确;②负极上氢气失电子生成氢离子,所以负极反应为:O2+4H++4e- ═2H2O,正确;③将正负极电极反应式相加得总的化学反应为:2H2+O2═2H2O,正确; ④该电池放电时,阳离子向负电荷较多的正极移动,所以H+通过电解质向正极移动,正确.故正确说法是①②③④,选项A符合题意。
-
科目: 来源: 题型:
查看答案和解析>>【题目】水合肼 (N2H4·H2O) 常用作还原剂和抗氧剂,其熔点为 -40℃,沸点 118.5℃,极毒。实验室用如下装置制取水合肼(N2H4·H2O)涉及下列反应:

CO(NH2)2+ 2NaOH +NaClO = Na2CO3 + N2H4·H2O + NaCl
N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl]
请回答下列问题:
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有 (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)将Cl2通入30%NaOH溶液制备NaClO的化学方程式 。
(3)实验时,如果将 NaOH 和NaClO的混合溶液一次性加入三颈烧瓶,可能会造成的结果是__________。
(4)实验时可根据_________判断N2H4·H2O开始蒸出。
(5)已知:N2H4·H2O + 2I2= N2↑+ 4HI + H2O。测定水合肼的质量分数可采用下列步骤:
①取1.250g试样,经溶解、转移、定容等步骤,配制250mL溶液。
②移取10.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,加20mL水,摇匀。
③将0.1000mol·L-1碘的标准溶液盛放在__________滴定管中(填“酸式”或“碱式”),当_____________停止滴定,消耗碘的标准溶液为18.00mL,则产品中N2H4·H2O的质量分数为__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)海带中富含碘,请简述检验碘的实验方案_____________________;
(2)已知反应2HI(g)═H2(g)+I2(g)的△H=+11kJmol-1,1molH2(g)、1molHI(g)分子中化学键断裂时分别需要吸收436KJ、299KJ的能量,则1molI2(g)分子中化学键断裂时需吸收的能量为_________kJ;
(3)Bodensteins研究了下列反应:2HI(g)
 H2(g)+I2(g)
H2(g)+I2(g)在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
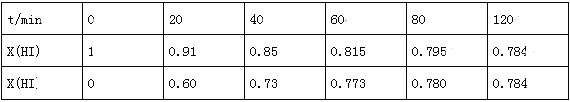
①根据上述实验结果,该反应的平衡常数K的计算式为:______________;(不用求出结果)
②其他条件不变,向平衡后体系中再加入少量HI,则平衡向_______(填“正”或“逆”)反应方向移动,达到平衡后x(HI)_______(填“增大”、“减小”或“不变”)。
③上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为_______(以K和K正表示);若k正=0.0027min-1,在t=40min时,v正=________min-1.
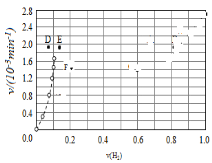
④由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为__________(填字母)。

-
科目: 来源: 题型:
查看答案和解析>>【题目】t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A.加热蒸发饱和Ag2CrO4溶液再恢复到t℃,可使溶液由Y点变到Z点
B.在X点没有Ag2CrO4沉淀生成,则此时温度低于t℃
C.向饱和Ag2CrO4溶液中加入少量AgNO3固体,可使溶液由Z点到Y点
D.在t℃时,Ag2CrO4的Ksp为1×10-9
-
科目: 来源: 题型:
查看答案和解析>>【题目】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某硫化锌精矿的主要成分为ZnS(还含少量 FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:

回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为___________。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作。
(3)浸出液“净化”过程中加入的主要物质为锌粉,其作用是__________________,反应的离子方程式为____________________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用 Pb-Ag 合金惰性电极,阳极逸出的气体是___________。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为________。
(6)硫化锌精矿(ZnS)遇到硫酸铜溶液可慢慢地转变为铜蓝(CuS)。请用简短的语言解释该反应发生的原理_______________________。
(7)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为____________。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了预防碘缺乏症,国家规定每千克食盐中应含有40~50 mg碘酸钾。碘酸钾晶体具有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂反应生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等更强的氧化剂氧化为更高价的碘的含氧酸盐。工业生产碘酸钾的流程如图所示。
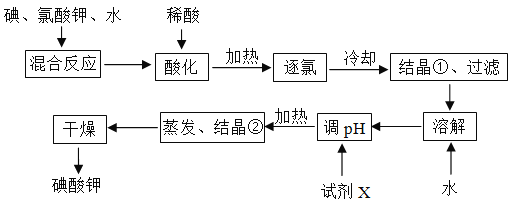
(1)碘在周期表中的位置为__________________;
(2)碘、氯酸钾、水混合反应时,若两种还原产物所得电子的数目相同,请配平该反应的化学方程式:____I2+____KClO3+____H2O=____KH(IO3)2+____KCl+____Cl2↑;
(3)混合反应后,用稀酸酸化的作用是___________________________,在稀盐酸和稀硝酸中不能选用的酸是_________,理由是__________________________________;
(4)试剂X的化学式为__________,写出用试剂X调pH的化学方程式__________________;
(5)如果省略“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应混合物的pH,对生产碘酸钾有什么影响?________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某无色混合气体可能由H2、O2、NH3、N2、CO2、HCl和He中的两种或多种组成。常温下取此气体200mL进行实验,实验的过程和结果如下(上述气体的体积都是折算成相同条件下的体积)。下列说法错误是

A.原混合气体中有5ml O2
B.原混合气体中肯定存在NH3,肯定不存在HCl
C.原混合气体中CO2的体积分数为40%
D.可能存在N2或He,它们在原混合气体中的体积分数不可能超过5%
相关试题

