【题目】碳、镁、镍在工业生产和科研领域有广泛用途。请回答下列问题:
(1)基态碳原子中,能量最高的电子所占用的能级符号为_________;该能级中原子轨道的电子云形状为______________________。
(2)从石墨中可剥离出由单层碳原子构成的石墨烯,石墨烯中碳原子和共价键的数目之比为________。
(3)Mg2+能形成多种配合物和配离子,如Na4[Mg(PO3)4]、Mg[EDTA]2- EDTA的结构简式为( )等。
)等。
①PO3-的立体构型为____________,其中心原子的杂化轨道类型为__________,其中杂化轨道的作用为__________________________。
② 是常用的分析试剂。其中位于同周期的三种基态原子第一电离能由小到大的顺序为________________(用元素符号表示);这三种元素形成的一种离子与CS2互为等电子体,该离子符号为_____________。
是常用的分析试剂。其中位于同周期的三种基态原子第一电离能由小到大的顺序为________________(用元素符号表示);这三种元素形成的一种离子与CS2互为等电子体,该离子符号为_____________。
(4)晶体镁的堆积模型为____________;其中镁原子的配位数为______________。
(5)碳、镁、镍形成的某晶体的晶胞结构如图所示。若晶体密度为ρg·cm-1,阿伏伽德罗常数的值为NA,则晶胞参数a=___________pm(用代数式表示)。

参考答案:
【答案】 2p 哑铃形(或纺锤形) 2:3 平面三角形 sp2 形成α键 C<O<N CNO- 六方最密堆积 12 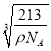
![]() 1010
1010
【解析】(1)基态碳原子核外有2个电子层,能量最高的电子所占用的能级符号为2p;该能级中原子轨道的电子云形状为纺锤形,故答案为:2p;纺锤形;
(2)石墨烯中每个碳原子与周围的3个碳原子通过共价键结合,每个碳原子含有![]() 个共价键,因此碳原子和共价键的数目之比为1:
个共价键,因此碳原子和共价键的数目之比为1: ![]() =
=![]() ,故答案为:
,故答案为: ![]() ;
;
(3)①PO3-中P原子的价层电子对数=3+![]() ×(5+1-2×3)=3,P原子采用sp2杂化,立体构型为平面三角形,其中杂化轨道形成σ键,故答案为:平面三角形; sp2;形成σ键;
×(5+1-2×3)=3,P原子采用sp2杂化,立体构型为平面三角形,其中杂化轨道形成σ键,故答案为:平面三角形; sp2;形成σ键;
② 是常用的分析试剂。其中位于同周期的三种基态原子为C、N、O,由于N原子的2p为半充满结构,较为稳定,第一电离能由小到大的顺序为C<O<N;这三种元素形成的一种离子与CS2互为等电子体,该离子为CNO-,故答案为:C<O<N ;CNO-;
是常用的分析试剂。其中位于同周期的三种基态原子为C、N、O,由于N原子的2p为半充满结构,较为稳定,第一电离能由小到大的顺序为C<O<N;这三种元素形成的一种离子与CS2互为等电子体,该离子为CNO-,故答案为:C<O<N ;CNO-;
(4)晶体镁的堆积模型为六方最密堆积;其中镁原子的配位数为12,故答案为:六方最密堆积;12;
(5)该晶胞中C原子个数=1,Mg原子个数=8×![]() =1,Ni原子个数=6×
=1,Ni原子个数=6×![]() =3,1mol晶胞的质量为12+24+59×3=213g,则ρg·cm-1=
=3,1mol晶胞的质量为12+24+59×3=213g,则ρg·cm-1=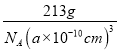 ,解得a=
,解得a=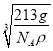 ×1010pm,故答案为:
×1010pm,故答案为: 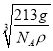 ×1010。
×1010。
-
科目: 来源: 题型:
查看答案和解析>>【题目】准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)加入100mL硫酸溶液,充分反应后向滤液中加入10mol/L的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则硫酸溶液的物质的量浓度为

A. 3.50mol/L B. 1.75mol/L
C. 0.85mol/L D. 无法计算
-
科目: 来源: 题型:
查看答案和解析>>【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 27g铝中加入lmol/L的NaOH溶液,转移电子数是3NA
B. 56gN2与CO混合物中原子总数是4NA
C. 标准状况下,44.8LNO与22.4LO2反应后的分子数是2NA
D. 常温下,lLpH=1的H2SO4溶液中的H+为0.2NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】按构造原理写出第11、15、19号元素原子的电子排布式。它们的核外电子分别有几层_______?最外层电子数分别为多少_____?
-
科目: 来源: 题型:
查看答案和解析>>【题目】水是最普通、最常见的物质之一。
(1)“水”有很多种。下列“水”属于纯净物的是 ________ (填字母序号)。
A.河水 B.自来水 C.矿泉水 D.蒸馏水
(2)电解水可证明水由氢、氧两种元素组成,该反应的化学方程式为________ 。
(3)水是重要的溶剂和化工原料。氯碱工业以饱和食盐水为原料获得烧碱等化工产品,反应原理为:
 。
。 ①20℃时,NaCl 的溶解度是36 g。该温度下,饱和食盐水中溶质与溶剂的质量比为______。
②烧碱可用于处理硫酸泄漏,反应的化学方程式为__________。
(4)水在化学实验中具有重要作用。将铁丝放在潮湿的空气中(如下图所示),一段时间后,观察到导管内液面下降,导管口有气泡冒出,关闭 K。请解释导管内液面上升和下降的原因:___________________________。

-
科目: 来源: 题型:
查看答案和解析>>【题目】将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确的是
A. 标准状况下,反应过程中得到7.84 L的气体
B. 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C. 最终得到7.8 g的沉淀
D. 最终得到的溶液中c(Na+)=1.5 mol·L-1
-
科目: 来源: 题型:
查看答案和解析>>【题目】将铁的化合物溶于盐酸,滴加KSCN溶液,不发生颜色变化,再加入适量氯水,溶液立即呈红色的是( )
A. Fe2O3 B. FeCl3 C. Fe2(SO4)3 D. FeO
相关试题

