
【题目】同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。
已知:P4(s,白磷)+5O2(g)=P4O10(s) ΔH=-2983.2 kJ·mol-1①
P(s,红磷)+![]() O2(g)=
O2(g)=![]() P4O10(s) ΔH=-738.5 kJ·mol-1②
P4O10(s) ΔH=-738.5 kJ·mol-1②
则白磷转化为红磷的热化学方程式为_______。相同状况下,能量状态较低的是______;白磷的稳定性比红磷的_______(填“高”或“低”)。
【答案】P4(s,白磷)=4P(s,红磷) ΔH=-29.2 kJ·mol-1 红磷 低
【解析】
利用盖斯定律可以解答,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得,物质的能量越低越稳定.
已知:P4(s,白磷)+5O2(g)=P4O10(s) ΔH=-2983.2 kJ·mol-1①
P(s,红磷)+![]() O2(g)=
O2(g)=![]() P4O10(s) ΔH=-738.5 kJ·mol-1②
P4O10(s) ΔH=-738.5 kJ·mol-1②
据盖斯定律,①-②×4可得:P4(s,白磷)=4P(s,红磷)△H=-29.2 kJ·mol-1
从上面的热化学方程式可见,相同状况下,白磷比红磷能量高;因为能量越低越稳定,所以红磷比白磷稳定。


科目:高中化学 来源: 题型:
【题目】按要求填空
(1)1mol Na2O2固体与水完全反应时转移的电子数_____________,反应的离子方程式为________________。
(2)工业上由辉铜矿生产铜的主要反应为:Cu2S+O2![]() 2Cu+SO2,该反应中被还原的元素是__________(填元素符号)。
2Cu+SO2,该反应中被还原的元素是__________(填元素符号)。
(3)反应(2)中产生的SO2尾气可用NaOH溶液吸收,若用1L 1mol/L的NaOH溶液吸收标准状况下22.4L SO2,反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,下列各组热化学方程式中,△H1<△H2是( )
A. C(s)+![]() O2(g)=CO(g);△H1C(s)+O2(g)=CO2(g);△H2
O2(g)=CO(g);△H1C(s)+O2(g)=CO2(g);△H2
B. ![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
C. 2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2
D. S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g); △H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用如图所示装置,对浓硝酸与木炭的反应进行探究(已知:4HNO3![]() 4NO2↑+O2↑+2H2O)。
4NO2↑+O2↑+2H2O)。
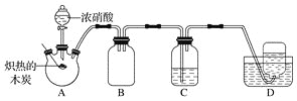
请回答下列问题:
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至炽热状态,伸入三颈烧瓶中,生成的气体的颜色为__,产生该气体的反应的化学方程式是__。
(2)装置C中盛有足量Ba(OH)2溶液,炽热的木炭与浓硝酸反应后可观察到C中出现白色沉淀,该白色沉淀为__(填化学式)。
(3)装置B的作用是__。
(4)装置D中收集到了无色气体,有同学认为是NO,还有同学认为是O2。
①下列对该气体的检验方法合适的是__(填字母)。
A.敞口观察装置D中集气瓶内气体的颜色变化
B.将湿润的蓝色石蕊试纸伸入集气瓶内,观察蓝色石蕊试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果D中集气瓶内收集到的无色气体是氧气,则氧气的来源是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员在钠离子电池研究中又取得新突破。钠离子电池与锂离子电池工作原理相同、制造工艺相似,而且具有资源丰富、成本低廉、安全性能好等特点。一种钠离子电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解质溶液为的碳酸丙烯酯溶液。
回答下列问题:
(1)基态Na原子的电子排布式为__,最高能层电子云轮廓图形状为___。
(2)Te与S同主族,与![]() 同周期,Te属于元素周期表中__区元素,其基态原子的价电子排布图(即轨道表示式)为___。
同周期,Te属于元素周期表中__区元素,其基态原子的价电子排布图(即轨道表示式)为___。
(3)碳酸丙烯酯的结构简式为![]() ,则其中π键和σ键的数目之比为___,碳原子的杂化轨道类型为____。
,则其中π键和σ键的数目之比为___,碳原子的杂化轨道类型为____。
(4)C元素的最高价氧化物的电子式为___,CO32-的VSEPR模型名称是___,ClO4-的立体构型是__。
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是__,该配离子包含的作用力为___(填选项字母)。
A.极性键 B.金属键 C.氢键 D.配位键
(6)由原料制备负极材料的反应过程中,是否有电子转移___(填“是”或者“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、 Y、 Z、 M、 Q、 R为短周期元素, 其原子半径和最外层电子数之间的关系如图所示。下列说法错误的是

A.元素的金属性: Q<RB.R 的氧化物可能含共价键
C.热稳定性: ZX3<YX4D.X2M 的水溶液露置于空气中易变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的密闭容器中通入0.4molSO2和0.2molO2发生反应2SO2+O2![]() 2SO3,下列叙述正确的是( )
2SO3,下列叙述正确的是( )
A. 若反应中加入的是18O2,达到平衡后SO2中不可能含有18O
B. 平衡时,SO3的浓度可能为0.2mol/L
C. 当不再生成SO3时反应达到平衡
D. 温度不变,改变SO2和O2的加入量,![]() 达到平衡时不变
达到平衡时不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在工业、农业和国防科技中有重要应用,我国已是生产钢铁最多的国家。回答下列问题:
(1) 工业上以磁铁矿和焦炭为原料冶炼铁存在以下变化:
①Fe3O4(s)+4C(s)=3Fe(s)+4CO(g) ΔH1=+678kJ·mol-1 ②CO(g)+![]() O2(g)=CO2(g) ΔH2=-283kJ·mol-1
O2(g)=CO2(g) ΔH2=-283kJ·mol-1
③C(s) +![]() O2(g)=CO(g) ΔH3=-110kJ·mol-1 ④Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) ΔH4
O2(g)=CO(g) ΔH3=-110kJ·mol-1 ④Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) ΔH4
则ΔH4=____kJ·mol-1。
(2)铁矿石中常含有硫, 使高炉尾气中混有SO2, 除去高炉尾气中SO2 的物质是___。生产中发现, 无论怎么改变原料配比与条件, 在高炉尾气中始终有CO, 原因是___。
(3)在温度 aK时,反应Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g)的浓度平衡常数Kc=16(用浓度计算所得),则用分压(分压等于总压×体积分数)代替浓度算得的平衡常数Kp ___Kc(填 “大于”“小于” 或 “等于”)。平衡混合气体中CO的体积分数为___(保留两位有效数字)。
(4) aK 时,在体积为 2L 的密闭容器中,加入 Fe、 Fe3O4、 CO、 CO2各1.0mol,气体的压强为PkPa。
①此时,v 正(CO2) ___v 逆(CO)(填 “大于”“小于” 或 “等于”), 反应经过5min后达到平衡, 该时间范围内的平均反应速率 v(CO2)=___mol/(L·min)(保留两位有效数字)。
②已知:恒容条件下,相同分子数的气体,其压强与温度成正比。平衡后温度从 aK逐渐升高到3aK, 请在下图中绘制出CO分压(PCO的变化曲线)_______ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究1,3-丁二烯和Br2以物质的量之比为1∶1加成时的反应:
![]() ;
;![]()
文献:Ⅰ.一般情况,在相同条件下,化学反应的活化能(E)越大,化学反应速率越小。
Ⅱ.1,3-丁二烯和Br2以物质的量之比为1∶1加成时的反应过程和能量变化的示意图如下:

(1)已知:
![]() ΔH1=-a(a>0) kJ·mol1 ;
ΔH1=-a(a>0) kJ·mol1 ; ![]() ΔH2=+c(c>0) kJ·mol1
ΔH2=+c(c>0) kJ·mol1
①稳定性:A ______ B(填“>”、“=”或“<”)。
②气态1,3-丁二烯和液态Br2以物质的量之比为1∶1加成生成液态B的热化学方程式是______。
(2)探究1,2-加成和1,4-加成的影响因素。
实验1 将1,3-丁二烯和Br2以物质的量之比1∶1加成,不同温度,相同时间内测定A和B在产物中的含量,低温时产物以A为主,较高温时以B为主。
实验2 加热实验1中低温时的反应产物,A的含量减少,B的含量增大。
实验3 在实验1的基础上,充分延长反应时间,无论是低温还是高温,产物中B的含量均增大。
①结合反应过程和能量变化的示意图,解释实验1中低温时产物以A为主的原因:______。
②说明实验2中,升高温度,A转化为B经历的物质转化过程:______。
③综上所述,有利于1,4加成的措施是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com