【题目】气在生产、生活中有广泛用途,研究其制取、性质和用途十分重要.
(1)工业上用氮气和氢气在高温高压和催化剂存在时合成氨;实验室用氯化铵和熟石灰在加热条件下制取氨气,同时生成氯化钙和水.请分别写出有关反应的化学方程式___________.实验室制取氨气的发生装置与制取哪种气体的相似,请写出实验室制取该气体的化学方程式:__________
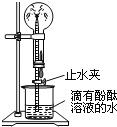
(2)如图是氨气性质的趣味实验:圆底烧瓶中充满氨气,当挤压胶头滴管并打开止水夹时,烧杯中的水迅速进入烧瓶,形成美丽的“喷泉”,进入烧瓶的水变成红色.由该实验可得出哪些结论___________
(3)氨气常作制冷剂及化肥,同时,它还可作清洁能源.已知表信息:
性质 | 颜色、气味 | 沸点(℃) | 25℃水中溶解度(g/L-1) |
NH3 | 无色、刺激性 | -33 | 456 |
H2 | 无色、无味 | -253 | 0.0015 |
一定条件下氨气在纯氧中完全燃烧生成水和氮气,写出该反应的化学方程式______________________.
液氨有望和液氢一样成为新一代绿色能源.与H2相比,用NH3作燃料的优点之一是便于储存和运输;优点之二是泄漏时易发现且便于处理.请对氨气的优点加以解释说明_________________
参考答案:
【答案】N2+3H2 2NH3;2NH4Cl+Ca(OH)2
2NH3;2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O 2KMnO4
2NH3↑+CaCl2+2H2O 2KMnO4![]() K2MnO4+MnO2+O2↑ 氨气极易溶于水,氨水呈碱性 4NH3+3O2
K2MnO4+MnO2+O2↑ 氨气极易溶于水,氨水呈碱性 4NH3+3O2 2N2+6H2O 氨气比氢气沸点高,所以更易液化,便于储存和运输;氨气具有刺激性气味,氨气易溶于水,所以氨气泄漏时易被发现,同时也便于处理
2N2+6H2O 氨气比氢气沸点高,所以更易液化,便于储存和运输;氨气具有刺激性气味,氨气易溶于水,所以氨气泄漏时易被发现,同时也便于处理
【解析】
(1)工业上用氮气和氢气合成氨气,反应的化学方程式:N2+3H2 2NH3;实验室制取氨气反应物为氯化铵(NH4Cl)晶体和熟石灰(Ca(OH)2)粉末,反应条件为加热,因此选择的发生装置为固固体加热”型;生成氨气、氯化钙和水,因此反应原理为2NH4Cl+Ca(OH)2
2NH3;实验室制取氨气反应物为氯化铵(NH4Cl)晶体和熟石灰(Ca(OH)2)粉末,反应条件为加热,因此选择的发生装置为固固体加热”型;生成氨气、氯化钙和水,因此反应原理为2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O;实验室用高锰酸钾制取氨气,属于固固加热型,与实验室制取氨气的发生装置相似;2KMnO4
2NH3↑+CaCl2+2H2O;实验室用高锰酸钾制取氨气,属于固固加热型,与实验室制取氨气的发生装置相似;2KMnO4![]() K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
(2)从挤压胶头滴管能形成喷泉,其原因是烧瓶内气压变小,导致气压变化的是氨气极易溶于水,由于生成了红色喷泉说明氨水能使酚酞试液变红,可知氨水呈碱性;
(3)一定条件下氨气在纯氧中完全燃烧生成水和空气中含量最多的一种气体(氮气),反应的化学方程式为:4NH3+3O2 2N2+6H2O.
2N2+6H2O.
图表可知氨气比氢气沸点高,所以更易液化,便于储存和运输;氨气具有刺激性气味,氨气易溶于水,所以氨气泄漏时易被发现,同时也便于处理.
-
科目: 来源: 题型:
查看答案和解析>>【题目】现有CO和CO2混合气体,采用图是实验室装置可以:①检验CO2气体,②分离CO和CO2混合气体,③干燥CO2或CO气体.实验所需的试剂有:稀盐酸、浓硫酸、氢氧化钠溶液和澄清石灰水.下列说法不正确的是( )
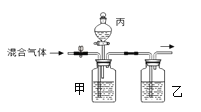
A. 甲中应盛放氢氧化钠和石灰水的混合溶液
B. 乙中应盛放浓硫酸
C. 丙中应盛放稀盐酸
D. 首先分离得到的是CO2 气体,而后得到CO气体
-
科目: 来源: 题型:
查看答案和解析>>【题目】用化学用语填空:
(1)标出硫酸铁中铁元素的化合价:____________ (2)3个铵根离子:___________
(3) CO2中2的含义:_____________ (4)密度最小的金属元素:___________
(5)酒精在氧气中完全燃烧的化学方程式:______________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】过氧化氢俗称双氧水,它可用过氧化钡(BaO2 )与稀硫酸反应来制备.过氧化氢与过氧化钡都是过氧化物,过氧化物一般可用作氧化剂、漂白剂、供氧化剂等.阅读下文并回答有关问题:
(1)实验室可用过氧化氢溶液制取氧气.可用过氧化钡通过以下方式制备过氧化氢:BaO2+X+H2O═BaCO3↓+H2O2.其中物质X的化学式是_____________.
(2)过氧化钠(Na2O2 )也是一种过氧化物,潜水艇常用过氧化钠作供氧剂,同时维持艇内空气成分的稳定.请写出这一反应的化学方程式_______________ .
(3)过氧化钡由离子构成。写出过氧化钡中阴离子的符号__________,标出过氧化钡中各元素的化合价______
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知碳酸亚铁在隔绝空气的条件下,受热易分解生成氧化亚铁和二氧化碳:在空气中加热,则生成氧化铁和二氧化碳.某化学兴趣小组用如图所示的装置模拟炼铁过程,并测定某样品中碳酸亚铁的含量(该装置气密性良好,B中氢氧化钠溶液足量).实验过程中,先打开K通入一氧化碳再加热;装置A中固体质量不再减少后,停止加热,待装置A冷却到室温后关闭K,实验测得装置A中固体质量减少了ag,装置B中液体质量增加了bg.
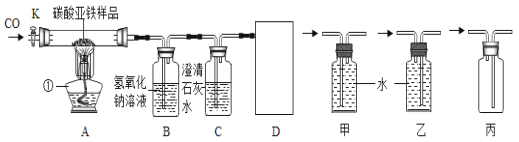
回答下列问题:
(1)仪器①的名称是____________;
(2)写出装置A中发生的反应的化学方程式_____________;
(3)实验前先通CO后加热的原因是_______;实验结束时待装置冷却后再关闭K的原因是_____________
(4)能判断生成的二氧化碳全部被装置B吸收的依据是:装置B的质量增加且_______;
(5)若生成的二氧化碳全部被装置B吸收,不考虑水的蒸发且该样品中所含杂质不参加反应,则a____b(填“>”“=”或“<”);
(6)D处为收集尾气的装置,应选择______装置(填“甲”“乙”或“丙”)
-
科目: 来源: 题型:
查看答案和解析>>【题目】亚硝酸钠是实验室常用的试剂,实验室一般用亚硝酸钠溶液与氯化铵溶液反应来制取N2。N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3(转化率很低).下图为制取少量NH3的装置(制取H2的装置已略去):
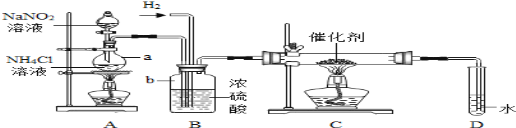
(1)指出标号仪器的名称a______,b______.
(2)A装置中除有N2生成外,还有水和氯化钠生成,写出反应的化学方程式__________.
(3)C装置的硬质试管中发生反应的化学方程式为_____________
(4)写出实验室制取H2的化学方程式___________,反应时N2和H2的最佳质量比是______,上述装置中是使产生平稳气流的方式是____________________
(5)B装置的作用是____________.(至少答两点)
(6)氨气极易溶解在水中,但是D装置却没有采用防倒吸装置,小丽认为装置没有错,理由是__________
(7)上述装置的缺陷是______________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C、D、E、F、G、H、I都是初中化学学过的物质.其中E、F、H均为黑色固体,B为紫红色固体,D为蓝色沉淀.他们之间有如图的转化关系(部分生成物已省去).

(1)用化学式表示D的组成______ ;
(2)F→G的反应类型______;
(3)写出F→E的化学方程式_______________-;
(4)写出G→I的化学方程式______________
(5)指出B的一种用途______.
相关试题

