【题目】亚硝酸钠是实验室常用的试剂,实验室一般用亚硝酸钠溶液与氯化铵溶液反应来制取N2。N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3(转化率很低).下图为制取少量NH3的装置(制取H2的装置已略去):
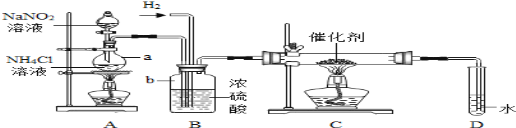
(1)指出标号仪器的名称a______,b______.
(2)A装置中除有N2生成外,还有水和氯化钠生成,写出反应的化学方程式__________.
(3)C装置的硬质试管中发生反应的化学方程式为_____________
(4)写出实验室制取H2的化学方程式___________,反应时N2和H2的最佳质量比是______,上述装置中是使产生平稳气流的方式是____________________
(5)B装置的作用是____________.(至少答两点)
(6)氨气极易溶解在水中,但是D装置却没有采用防倒吸装置,小丽认为装置没有错,理由是__________
(7)上述装置的缺陷是______________________
参考答案:
【答案】烧瓶 集气瓶 NaNO2+NH4Cl![]() N2↑+2H2O+NaCl 3H2+N2
N2↑+2H2O+NaCl 3H2+N2 ![]() 2NH3 Zn+H2SO4=ZnSO4+H2↑ 14:3 控制分液漏斗的滴加速度 干燥氨气、干燥氢气 因为氨气的转化率很低,生成的氨气很少也就是进入D试管的气体中含有较少的氨气 转化率低
2NH3 Zn+H2SO4=ZnSO4+H2↑ 14:3 控制分液漏斗的滴加速度 干燥氨气、干燥氢气 因为氨气的转化率很低,生成的氨气很少也就是进入D试管的气体中含有较少的氨气 转化率低
【解析】
(1)a是烧瓶,b是集气瓶.
(2)A装置中除有N2生成外,还有水和氯化钠生成,对应的化学方程式 NaNO2+NH4Cl![]() N2↑+2H2O+NaCl.
N2↑+2H2O+NaCl.
(3)C装置的硬质试管中,氢气和氮气在催化剂的作用下受热反应生成氨气,反应的化学方程式为:3H2+N2![]() 2NH3.
2NH3.
(4)实验室制取氢气是用锌和稀硫酸反应生成硫酸锌和氢气,对应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;由化学方程式为:3H2+N2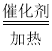 2NH3可知反应时N2和H2的最佳质量比是:(14×2):(2×3)=14:3;上述装置中是使产生平稳气流的方式由于给出的装置有分液漏斗,可以通过分液漏斗的控制实现反应速率的控制,所以控制分液漏斗的滴加速度.
2NH3可知反应时N2和H2的最佳质量比是:(14×2):(2×3)=14:3;上述装置中是使产生平稳气流的方式由于给出的装置有分液漏斗,可以通过分液漏斗的控制实现反应速率的控制,所以控制分液漏斗的滴加速度.
(5)B中浓硫酸的作用是干燥氢气和氮气.
(6)氨气极易溶解在水中,但是D装置却没有采用防倒吸装置,题干提示信息是转化率很低,所以理由是因为氨气的转化率很低,生成的氨气很少也就是进入D试管的气体中含有较少的氨气.
(7)根据给出的信息可知,此种方法转化率低,则能耗等大,合理即可.
-
科目: 来源: 题型:
查看答案和解析>>【题目】过氧化氢俗称双氧水,它可用过氧化钡(BaO2 )与稀硫酸反应来制备.过氧化氢与过氧化钡都是过氧化物,过氧化物一般可用作氧化剂、漂白剂、供氧化剂等.阅读下文并回答有关问题:
(1)实验室可用过氧化氢溶液制取氧气.可用过氧化钡通过以下方式制备过氧化氢:BaO2+X+H2O═BaCO3↓+H2O2.其中物质X的化学式是_____________.
(2)过氧化钠(Na2O2 )也是一种过氧化物,潜水艇常用过氧化钠作供氧剂,同时维持艇内空气成分的稳定.请写出这一反应的化学方程式_______________ .
(3)过氧化钡由离子构成。写出过氧化钡中阴离子的符号__________,标出过氧化钡中各元素的化合价______
-
科目: 来源: 题型:
查看答案和解析>>【题目】气在生产、生活中有广泛用途,研究其制取、性质和用途十分重要.
(1)工业上用氮气和氢气在高温高压和催化剂存在时合成氨;实验室用氯化铵和熟石灰在加热条件下制取氨气,同时生成氯化钙和水.请分别写出有关反应的化学方程式___________.实验室制取氨气的发生装置与制取哪种气体的相似,请写出实验室制取该气体的化学方程式:__________
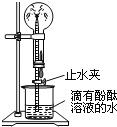
(2)如图是氨气性质的趣味实验:圆底烧瓶中充满氨气,当挤压胶头滴管并打开止水夹时,烧杯中的水迅速进入烧瓶,形成美丽的“喷泉”,进入烧瓶的水变成红色.由该实验可得出哪些结论___________
(3)氨气常作制冷剂及化肥,同时,它还可作清洁能源.已知表信息:
性质
颜色、气味
沸点(℃)
25℃水中溶解度(g/L-1)
NH3
无色、刺激性
-33
456
H2
无色、无味
-253
0.0015
一定条件下氨气在纯氧中完全燃烧生成水和氮气,写出该反应的化学方程式______________________.
液氨有望和液氢一样成为新一代绿色能源.与H2相比,用NH3作燃料的优点之一是便于储存和运输;优点之二是泄漏时易发现且便于处理.请对氨气的优点加以解释说明_________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知碳酸亚铁在隔绝空气的条件下,受热易分解生成氧化亚铁和二氧化碳:在空气中加热,则生成氧化铁和二氧化碳.某化学兴趣小组用如图所示的装置模拟炼铁过程,并测定某样品中碳酸亚铁的含量(该装置气密性良好,B中氢氧化钠溶液足量).实验过程中,先打开K通入一氧化碳再加热;装置A中固体质量不再减少后,停止加热,待装置A冷却到室温后关闭K,实验测得装置A中固体质量减少了ag,装置B中液体质量增加了bg.
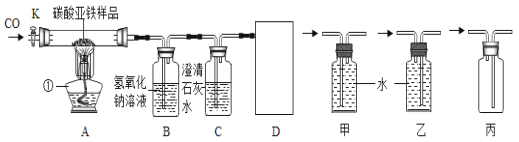
回答下列问题:
(1)仪器①的名称是____________;
(2)写出装置A中发生的反应的化学方程式_____________;
(3)实验前先通CO后加热的原因是_______;实验结束时待装置冷却后再关闭K的原因是_____________
(4)能判断生成的二氧化碳全部被装置B吸收的依据是:装置B的质量增加且_______;
(5)若生成的二氧化碳全部被装置B吸收,不考虑水的蒸发且该样品中所含杂质不参加反应,则a____b(填“>”“=”或“<”);
(6)D处为收集尾气的装置,应选择______装置(填“甲”“乙”或“丙”)
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C、D、E、F、G、H、I都是初中化学学过的物质.其中E、F、H均为黑色固体,B为紫红色固体,D为蓝色沉淀.他们之间有如图的转化关系(部分生成物已省去).

(1)用化学式表示D的组成______ ;
(2)F→G的反应类型______;
(3)写出F→E的化学方程式_______________-;
(4)写出G→I的化学方程式______________
(5)指出B的一种用途______.
-
科目: 来源: 题型:
查看答案和解析>>【题目】现有32g某可燃物用在密闭容器中完全燃烧后,测得生成88g二氧化碳和72g水,关于该可燃物的说法正确的是(_____)
A.一定含有碳、氢元素,可能含有氧元素 B.只含有碳、氢两种元素
C.一定含有碳、氢、氧三种元素 D._____________________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】对下列实验中出现的异常现象,分析合理的是(______)
A、制取CO2时,始终收集不到气体——收集CO2的集气瓶没盖严
B、测量空气中氧气含量时,测量值小于1/5——伸入白磷的速度过慢
C、过滤时发现过滤速度很慢——滤纸没有紧贴烧杯内壁
D、向澄清石灰水中通新制取出的CO2,沉淀消失——____________________________(化学方程式)
相关试题

