【题目】酸、碱、盐在生产和生活中应用广泛。
(1)下列物质露置于空气中一段时间后,会因变质而使溶液质量明显增加的是_(填字母代号)。
A 食盐水
B 浓硫酸
C 烧碱溶液
D 石灰水
(2)硫酸铵与熟石灰混合施用会降低肥效,有关反应的化学方程式为_。
(3)实验课上,小强将生锈铁钉放入稀盐酸中,观察到铁锈(主要成分是氧化铁)逐渐溶解,并有气泡产生,溶液由无色逐渐变为黄色,除去铁锈的化学方程式为_,请解释产生气泡的原因_。
(4)某同学为了除去NaCl溶液中的CaCl2、MgCl2、Na2SO4杂质制取精盐,设计如下实验流程:

①操作a和操作b都要用到的玻璃仪器是_。
②写出一个可使精盐中氯化钠质量增加的化学方程式_。
③固体B的成分是什么?__。
(5)取10g氯化钠溶液于烧杯中,加入足量的硝酸银溶液,充分反应后过滤,将滤渣洗涤烘干后得到2.87g固体,请计算该氯化钠溶液中溶质的质量 __ 。
参考答案:
【答案】C (NH4)2SO4+Ca(OH)2=CaSO4+2H2O+2NH3↑ Fe2O3+6HCl=2FeCl3+3H2O Fe+2HCl=FeCl2+H2↑ 玻璃棒 Na2CO3+2HCl═2NaCl+H2O+CO2↑ 硫酸钡、氢氧化镁、碳酸钙、碳酸钡 1.17g
【解析】
(1)下列物质露置于空气中一段时间后,会因变质而使溶液质量明显增加的是烧碱溶液,是因为氢氧化钠能和空气中的二氧化碳反应生成碳酸钠,变质后溶液质量增大。
故选:C。
(2)硫酸铵与熟石灰混合施用会降低肥效,是因为硫酸铵和氢氧化钙反应生成硫酸钙、水和氨气,有关反应的化学方程式为:(NH4)2SO4+Ca(OH)2=CaSO4+2H2O+2NH3↑。
(3)实验课上,小强将生锈铁钉放入稀盐酸中,观察到铁锈(主要成分是氧化铁)逐渐溶解,并有气泡产生,溶液由无色逐渐变为黄色,是因为氧化铁和盐酸反应生成氯化铁和水,除去铁锈的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O,产生气泡,是因为铁和盐酸反应生成氯化亚铁和氢气,反应的化学方程式:Fe+2HCl═FeCl2+H2↑。
(4)①操作a(过滤)和操作b(蒸发)都要用到的玻璃仪器是玻璃棒。
②碳酸钠能和盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式:Na2CO3+2HCl═2NaCl+H2O+CO2↑。
③固体B的成分是硫酸钡、氢氧化镁、碳酸钙、碳酸钡。
(5)解:设氯化钠质量为x,
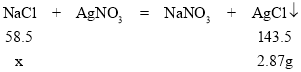
![]()
x=1.17g,
答:该氯化钠溶液中溶质的质量是1.17g。
-
科目: 来源: 题型:
查看答案和解析>>【题目】早在春秋战国时期我国就开始生产和使用铁器。工业上炼铁的原理是利用一氧化碳和氧化铁反应。某化学兴趣小组利用如图装置进行实验:
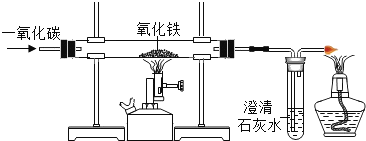
(1)实验前“通入CO”与“开始加热”的先后顺序是_____。
(2)酒精喷灯处玻璃管中发生反应的化学方程式为_____。
(3)右边导气管口放置点燃的酒精灯的目的是_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图为实验室制取气体的常用装置。
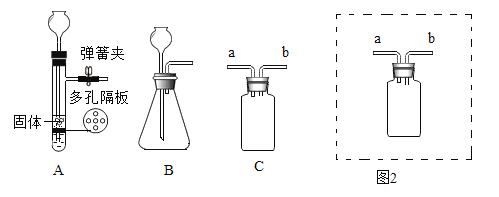
(1)写出用A装置制取二氧化碳的化学方程式__。
(2)A或B装置均可作制取H2的发生装置,与B装置相比,A装置的优点是能控制反应的发生和停止,请简述A装置中反应停止的原理__。
(3)若要用C装置收集一瓶O2,气体从b端进,请在图2的方框中将C装置补画完整_。
-
科目: 来源: 题型:
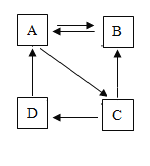
查看答案和解析>>【题目】A、B、C、D均含同一种金属元素,它们之间的转化关系如图(部分物质和反应条件已略去)。已知A为蓝色沉淀,C为黑色固体,D可用于配制波尔多液。则A的化学式是_;B属于_(填“酸”、“碱”或“盐”);由C转化为D的化学方程式为___。
-
科目: 来源: 题型:
查看答案和解析>>【题目】阅读下面科普短文。
酸奶营养丰富,富含人体生长发育所必须的多种营养物质,是人们喜爱的食品。
表 1 某品牌酸奶中主要营养成分的含量(每 100 克)
蛋白质/克
糖类/克
脂肪/克
钠/毫克
钙/毫克
2.7
9.5
2.7
75
90
但是,普通酸奶含有乳糖,经调查,我国有 88.9%的成人缺乏分解乳糖的乳糖酶,有55.1%的成年人表现有乳糖不耐受症状(主要症状为腹泻)。因此,在保证普通酸奶基本营养不损失的前提下,乳糖含量较低或无乳糖的酸奶成为乳糖不耐受消费者的需求。相关科研技术人员为满足消费者的需求,开始研发无乳糖酸奶。无乳糖酸奶的工艺流程为:原料乳 → 标准化 → 添加 6%的白砂糖 → 均质 → 巴氏杀菌 → 冷却→接种发酵剂(直投式发酵剂)→ 发酵(37℃、42℃)→ 4℃低温储存。
研究一 发酵酸奶中添加乳糖酶对乳糖水解效果的影响
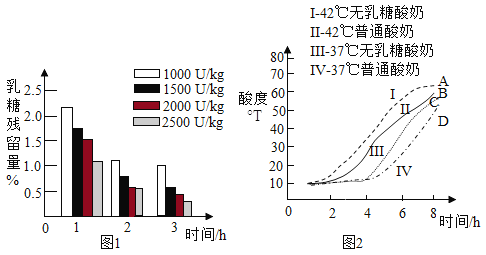
在 37℃,向普通酸奶中添加不同剂量乳糖酶(剂量分别为 1000U/kg、1500U/kg、2000U/kg、2500U/kg),发酵 3 小时,测得发酵酸奶中乳糖残留量随时间的变化,如图 1 所示。
研究二 普通酸奶和无乳糖酸奶发酵过程中的酸度变化
普通酸奶和无乳糖酸奶分别在 37℃和 42℃发酵 8 小时,发酵过程中酸度(从 1 小时开始测量)变化如图 2 所示。
除以上研究,科技人员还在口味、活菌数、保存等方面做了无乳糖酸奶与普通酸奶的对比研究,发现无乳糖酸奶都具有一定的优势。
依据文章内容回答下列问题。
(1)由表 1 可知酸奶的主要营养成分中含量最高的是_______。
(2)由图 1 可知:3 小时内,_______(填字母序号,下同)。
A添加相同量乳糖酶,发酵酸奶中乳糖残留量随时间的延长而降低
B相同发酵时间,乳糖残留量均随乳糖酶添加量的增大而降低
C乳糖残留量与温度、时间、乳糖酶添加量有关
(3)由图 2,影响无乳糖酸奶酸度的因素是_______。
(4)由图 2 可知:42℃时无乳糖酸奶发酵过程中酸度与时间的关系是_______。
(5)下列说法正确的是_______。
A我国绝大部分成年人都有乳糖不耐受症状
B表 1 中“钠”指的是钠元素
C无乳糖酸奶的工艺中至少两步属于化学变化
D无乳糖酸奶比普通酸奶适合更多消费者食用
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知 KNO3的溶解度如下表所示,下列说法不正确的是
温度/℃
10
20
30
40
50
60
70
溶解度/g
20.9
31.6
45.8
63.9
85.5
110
138
A.在 10℃-70℃之间,随着温度的升高,KNO3的溶解度增大
B.20℃时,向 100 g 水中加入 35 g KNO3,充分搅拌,所得溶液质量为 131.6 g
C.将 70℃时不饱和的 KNO3溶液降低温度,有可能转化为饱和溶液
D.50℃时,饱和 KNO3溶液中溶质的质量分数为 85.5%
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲和乙在催化剂作用下生成丙和丁,结合微观示意图分析,下列说法正确的是
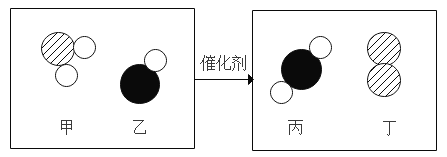

A.上述四种物质都属于化合物
B.生成丙和丁的分子个数比为 4:1
C.该化学反应前后,分子种类保持不变
D.甲中氮、氧元素的质量比为 1:2
相关试题

