【题目】同学们从山上采集到一种石灰石样品,为了测定石灰石样品中碳酸钙的质量分数(石灰石中的杂质不与盐酸反应,也不溶于水),取45g石灰石样品,逐渐加入稀盐酸,充分反应后,测得剩余固体质量与加入稀盐酸的质量关系如图所示,请计算:

(1)45g这种石灰石样品中碳酸钙的质量是_____g
(2)本实验是否可以用稀硫酸代替稀盐酸完成实验,并说明理由_____。
(3)列式计算45g石灰石与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数?_____。
参考答案:
【答案】40g 不能,因为碳酸钙和稀硫酸反应生成微溶的硫酸钙,硫酸钙覆盖在碳酸钙的表面阻碍碳酸钙与稀硫酸的接触导致不能继续反应,使反应慢慢停止 30%
【解析】
根据图可以看出剩余固体为5g,反应的碳酸钙的质量为45g﹣5g=40g,根据碳酸钙的质量和对应的化学方程式求算氯化钙的质量和二氧化碳的质量,进而求算对应的质量分数。
(1)由表可以看出剩余的固体为5g,则碳酸钙的质量为45g﹣5g=40g,故填:40g;
(2)实验过程中稀盐酸不能换成稀硫酸,因为碳酸钙和稀硫酸反应生成微溶的硫酸钙,硫酸钙覆盖在碳酸钙的表面阻碍碳酸钙与稀硫酸的接触导致不能继续反应,使反应慢慢停止。故填:不能,因为碳酸钙和稀硫酸反应生成微溶的硫酸钙,硫酸钙覆盖在碳酸钙的表面阻碍碳酸钙与稀硫酸的接触导致不能继续反应,使反应慢慢停止
(3)解:设二氧化碳的质量为x,生成氯化钙的质量为y
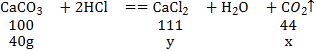
![]()
![]()
![]()
所得溶液中溶质的质量分数为![]() 。故填:30%
。故填:30%
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列四个图像分别对应四个变化,其中正确的是
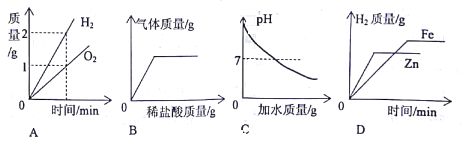
A. 将水通电一段时间后
B. 向氢氧化钾和碳酸钾的混合溶液中滴加过量稀盐酸
C. 向一定质量分数的氢氧化钠溶液中不断加水
D. 分别向等质量的铁粉和锌粉中加入过量的相同质量分数的稀硫酸
-
科目: 来源: 题型:
查看答案和解析>>【题目】以下是实验室制取、收集、干燥、存放气体的装置图,有关说法错误的是
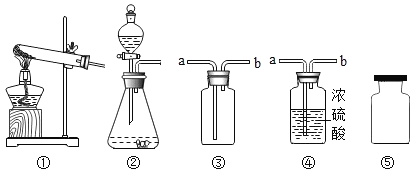
① ② ③ ④ ⑤
A. 实验室用双氧水制取氧气,用石灰石和稀盐酸制取二氧化碳均可使用装置②
B. 实验室收集氧气和二氧化碳均可使用装置③,气体从导管b进入
C. 实验室干燥氧气和二氧化碳均可使用装置④,气体从导管a进入
D. 实验室收集的氧气和二氧化碳,均可如图⑤临时存放
-
科目: 来源: 题型:
查看答案和解析>>【题目】某纯碱厂生产的某批次碳酸钠产品中可能含有氯化钠杂质。
定性检验
(1)要确定该产品中是否含有杂质氯化钠,你的方法是_________________。
定量测定:
(2)若利用沉淀法测定该产品中碳酸钠的质量分数,你确定的反应原理是(用化学方程式表示)_______________________________。
(3)假设你取样的质量为m1,根据你确定的反应原理,你需要通过实验测量沉淀(填化学式)____的质量(假设你测得的沉淀的质量为m2)。
(4)请你设计实验方案,获得数据m1、m2,把方案填在下表中。
适用的仪器名称
实验步骤
____________
______
(5)数据处理:
请用含m1、m2的式子表示所测样品中碳酸钠的质量分数,______________________。
分析讨论:
(6)要测定混合物中某成分的含量,可通过化学方法将不易测定的物质转化为易测量的物质。除沉淀法外,还可依据反应(用化学方程式表示)_______________来测定该纯碱样品中碳酸钠的质量分数。
-
科目: 来源: 题型:
查看答案和解析>>【题目】阅读下面材料,回答问题。
人类赖以生存的环境由自然环境和社会环境组成。自然环境由生物圈、岩石圈、大气圈、水圈组成(如图所示),四个圈层经过漫长演化,既相对稳定、动态平衡,又相互作用、不断变化,各圈层之间的物质和能量不停循环,这些循环既跟物质的组成、结构和性质有关,也受人类活动的影响,并通过复杂的物理变化和化学变化实现。

(一)内涵决定身份﹣﹣物质的组成与分类
(l)用化学符号填空:
岩石圈中含量最高的金属元素是_____。大气圈中含量最高的物质是_____。水圈中含量最高的元素是_____。土壤中能促进农作物根系发达的元素是_____。
(2)按要求填表:
物质所属圈层
物质名称
物质的化学式
用符号表示构成物质的微粒
物质类别
生物圈
蔗糖
_______
_______
_______
大气圈
氩气
_______
_______
_______
水圈
氢氧化钙
_______
_______
_______
岩石圈
_______
_______
Na+、SiO32﹣
_______
(二)甲烷﹣﹣小分子,大作为
在如图的四大圈层中,有下列6种物质:①甲烷;②水;③二氯化碳;④一氧化碳;⑤氢气;⑥氧气。构成这些物质的分子虽然简单,但这些物质有的是人类赖以生存的基本物质,有的是物质循环关键物质,有的是人类社会生产活动必需的物质。请回答:
(1)在这6种物质中,元素种类共有_____种,人类的生命活动不可缺少的物质有_____(填化学式,下同),植物生长必需的物质有_____,元素种类完全相同的物质是_____。
(2)甲烷是最重要的基础有机物之一,不仅可做燃料,还能发生如下反应:
①在隔绝空气和1000℃条件下,甲烷分解产生炭黑和氢气;
②在隔绝空气和1500℃条件下,甲烷分解产生乙炔和氢气;
③在1400℃条件下,适当比例的甲烷和氧气反应生成氢气和一氧化碳;
④在800℃和催化剂条件下,适当比例的甲烷和二氧化碳反应生成氢气和一氧化碳。
试写出上述②~④三个反应的化学方程式:
②_____;
③_____;
④_____;
(3)在反应①~④中,属于置换反应的有_____。
在反应①和②中,反应物相同,而生成物不同,从微观的角度看,是因为反应条件不同导致_____。
③和④两个反应的反应物不同,但生成物相同,从物质组成的角度看,其原因是_____。
在实际生产中,反应③需要按比例控制氧气不能超量,从物质性质的角度看,原因是_____。
(三)柔之力﹣﹣神奇的水溶液
水在生活、生产和科学实验中应用广泛。岩石圈约有四分之三被水覆盖,其中的某些物质被水溶解,其随水的天然循环在水圈中富集,富集后的物质可能再次沉积到岩石圈。
如图是氯化钠和碳酸钠的溶解度曲线。据图回答下列问题:
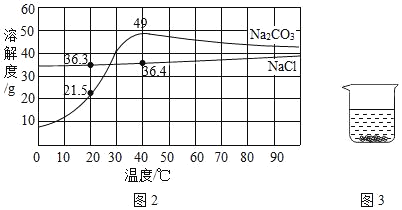
(1)青海湖区的人们有一种经验,冬天捞“碱”、夏天晒盐,这里的“碱”指纯碱,盐指氯化钠,他们所依据的原理是____。
(2)纯碱是一种重要的化工原料,但仅用物理方法从盐湖中“捞碱”远远不能满足需求,工业上主要利用从水圈中获得的食盐来制备纯碱,其反应的化学方程式是_____、_____。
(3)为确定某白色固体是碳酸钠还是氯化钠,在20℃时,取2.5g样品加入盛有10g水的烧杯中,充分搅拌后现象如图所示,则固体粉末是_____。若将该溶液升温到40℃时,则所得溶液溶质质量分数为_____。
(四)金属﹣﹣工业的脊梁
金属及合金广泛应用于生活、生产和航天军工。
资料:水圈和岩石圈中含有丰富的镁元素。工业生产中,可用菱镁矿做原科制'备金属镁,流程如图所示:
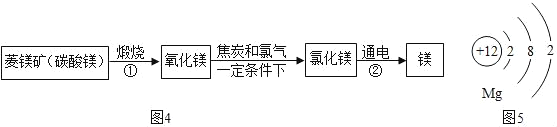
请回答下列问题:
(l)已知①和②属于分解反应,化学方程式分别为_____和_____。
(2)通过化学反应,以岩石圈的矿石为原料还可以制备很多其他金属,请举一例说明(用化学方程式表示其制备原理)_____。
(3)如图是镁原子结构示意图,镁化学性质活泼,原因是_____。四大圈层中含有下列物质:①硫酸锌;②氯化钠;③硫酸;④氢氧化钙;⑤氧气。其中能和铁反应的物质有(填序号)_____。
(4)小梅同学将点燃的镁条伸入盛二氧化碳的集气瓶中,看到镁条剧烈燃烧,发出耀眼白光,瓶壁上有黑色物质生成,她认为这种黑色物质是碳单质。在上述过程中,小梅运用的科学方法有_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】向盛有20g10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于溶液总质量或溶液pH随盐酸质量变化的关系图(Q点表示恰好完全反应)。其中正确的是

A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】通过分析、计算回答下列问题:
(1)相同质量的钠、镁、铝、钾中所含原子个数最多的是_____。
(2)N(NO2)3是科学家发现的一种新型火箭燃料,试计算:
①N(NO2)3的相对分子质量是_____。
②N(NO2)3中氮元素和氧元素的最简质量比是_____。
③N(NO2)3中氮元素的质量分数是_____精确到0.1%)。
(3)取一种可燃物3.2克充分燃烧,测得生成二氧化碳4.4克,水3.6克,试求:
①该可燃物中含有的元素各占多少克_____?(写出完整的计算过程)
②该可燃物的分子中各原子的个数比是_____。
相关试题

