【题目】为了测定一瓶硫酸铜溶液的溶质质量分数,取出50克该溶液,向其中逐滴加入溶质质量分数为16%的氢氧化钠溶液,反应过程中生成沉淀的质量与所用氢氧化钠溶液质量的关系如图所示:
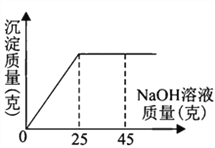
请你仔细分析此关系图,并进行计算。
(1)当滴入氢氧化钠溶液_____克时,硫酸铜与氢氧化钠恰好完全反应。
(2)计算此硫酸铜溶液中溶质的质量分数为_________(写出计算过程)。
参考答案:
【答案】 25 16%
【解析】(1)由图可知,当加入氢氧化钠的质量为25g时,硫酸铜与氢氧化钠恰好完全反应;
(2)设50克该溶液中硫酸铜的质量为x
2 NaOH + CuSO4= Na2SO4+Cu(OH)2![]()
80 160
25g![]() x
x
![]() =
=![]() ,解得x=8g
,解得x=8g
50克该溶液中硫酸铜的质量分数为![]() =16%
=16%
答:当滴入氢氧化钠溶液25克时,硫酸铜与氢氧化钠恰好完全反应,该硫酸铜溶液中硫酸铜的质量分数为16%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下图实验装置,回答问题。
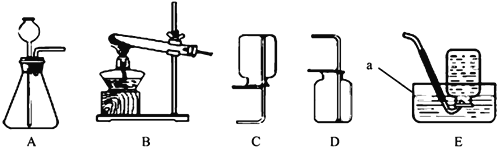
(1)图中仪器a的名称是___________。
(2)实验室用加热氯酸钾和二氧化锰混合物制取氧气的化学方程式为__________。用排空气法收集一瓶氧气,验满的方法是_________。
(3)实验室制取二氧化碳气体所选用的装置__________(填序号)。
(4)某化学小组利用混有少量CO2的CO气体还原氧化铁,并验证反应后的气体产物。
①请写出用CO气体还原氧化铁的化学方程式_________。
②实验室现有下图所示实验装置(可重复使用)。按气体从左到右的方向,装置连接顺序正确的是__________。
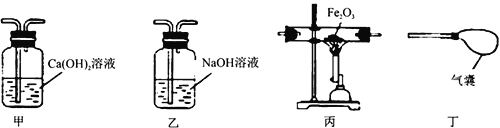
A.甲→乙→丙→丁 B.甲→丙→乙→丁
C.乙→甲→丙→甲→丁 D.乙→甲→丙→乙→丁
-
科目: 来源: 题型:
查看答案和解析>>【题目】某种手机电路板中含有Fe、Cu、Au、Ag、Ni(镍,银白色金属)等金属,如下是某工厂回收部分金属的流程图。已知:2Cu+O2+2H2SO4
 2CuSO4+2H2O
2CuSO4+2H2O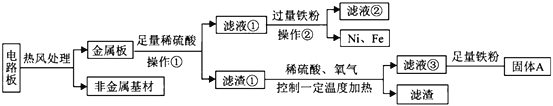
(1)操作①的名称是____________________。
(2)写出滤液②中金属阳离子符号____________________。
(3)写出滤液③和铁粉发生反应的一个化学方程式____________________________。
(4)Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是____________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验设计不能达到其对应实验目的的是( )
A.
 测定空气里氧气的含量 B.
测定空气里氧气的含量 B.  检查装置的气密性
检查装置的气密性C.
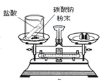 验证质量守恒定律 D.
验证质量守恒定律 D.  证明CO2密度比空气的大
证明CO2密度比空气的大 -
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙、丙有如图所示的转化关系(“→”表示反应一步实现,部分物质和反应条件已略去),下列各组物质按照甲、乙、丙的顺序不符合要求的是( )
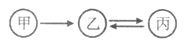
A. C、CO、CO2 B. H2O2、H2O、O2
C. KOH、K2CO3、KNO3 D. Fe2O3、FeCl3、Fe(OH)3
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是实验室制取气体的常用装置。
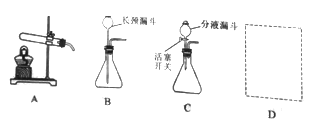
(1)写出一个用A装置制取O2的化学方程式___________。
(2)B和C装置均可制取CO2,与B相比较,C的主要优点是什么?___________
(3)用试管采用排空气法收集H2,请在D处方框中画出装置图(只画试管和导气管)。___________
相关试题

