【题目】硫酸的用途极广,常用于生产化肥、冶炼金属等。浓硫酸具有吸水性、脱水性和强腐蚀性等。工业制硫酸的流程:![]()
(1)①上述流程中一共出现了__________种氧化物,工业制H2SO4可能会引起的环境问题是___________。
②用小木棍蘸少量浓硫酸,放置一会儿后,可观察到蘸有浓硫酸的部位变__________色。
(2)某工厂用一定质量分数的稀硫酸处理含有Ba(OH)2的残液,变化关系如图。
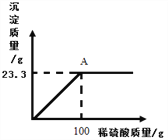
①A点液体的pH=__________(不考虑其它影响);
②所用稀硫酸的溶质质量分数为多少________(写出计算过程)。
参考答案:
【答案】 3 酸雨 黑 7 9.8%。
【解析】(1)氧化物是含有两种元素的化合物,其中一种是氧元素。由流程图可知,出现的氧化物有:二氧化硫、三氧化硫和水三种;硫酸会引起酸雨;浓硫酸具有脱水性,能将木条中的水脱去,生成黑色的碳;(2)氢氧化钡与硫酸反应生成硫酸钡沉淀和水,A点表示氢氧化钡与硫酸恰好完全反应,这时液体只有水,pH=7;利用化学方程式,根据硫酸钡与硫酸反应的质量比即可计算出稀硫酸中溶质的质量。
设稀硫酸中溶质的质量为x;
Ba(OH)2+H2SO4==BaSO4↓+H20
98 233
X 23.3g
![]() x=9.8g
x=9.8g
所用稀硫酸的溶质质量分数=![]() =9.8%
=9.8%
答:所用稀硫酸的溶质质量分数为9.8% 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请根据下图所示的实验装置图填空。
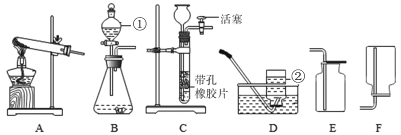
(1)D图中②的仪器名称为__________。
(2)实验室用B装置制取氧气时,发生反应的化学方程式为__________,
仪器①的作用是__________(写一点即可)。
(3)现有大理石、碳酸钠粉末、稀盐酸、稀硫酸,选择合适的物质用C装置制取CO2气体,其化学方程式为__________,在反应过程中,使反应停止的操作是__________。
(4)实验室常用加热醋酸钠和碱石灰的固体混合物来制取甲烷气体。甲烷是一种无色无味、密度比空气小、极难溶于水的气体,则制取并收集甲烷的装置组合是__________,若用右图装置收集甲烷,气体应从_________端导入(选填“a”或“b”)。

(5)小明同学用锌粒和稀盐酸制取氢气,小华认为小明制取的氢气不纯,杂质气体除了水蒸气外还含有__________(填化学式),基于以上问题,两位同学最终设计了如下方案制取纯净、干燥的氢气,请回答下列问题。
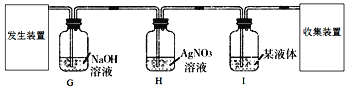
①H中硝酸银溶液的作用是__________;
②I中液体是__________(填名称)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】生活中的下列事件,利用了溶解原理的是
A. 将硬水变为软水 B. 用洗洁精洗去餐具上的油污
C. 用汽油洗去衣服上的油污 D. 海水晒盐
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于物质的组成和构成的说法不正确的是
A.酒精(C2H5OH)是由碳、氢、氧三种元素组成
B.二氧化碳分子是由碳原子和氧原子构成
C.氧气和臭氧都是由氧元素组成的单质
D.双氧水(H2O2)由氢分子和氧分子构成
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是a、b、c三种物质的溶解度曲线,下列说法正确的是

A.随温度升高,a、b、c三种物质的溶解度均增大
B.t2℃时,把50g a放入50g水中,可得到100g a的饱和溶液
C.将t2℃时等质量的a、b饱和溶液降温到t1℃,析出晶体的质量a大于b
D.t1℃时,a、c的溶解度相等,则两溶液的溶质质量分数也相等
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列化学用语与所表述的意义不相符的是
A.N2——氮气中氮元素的化合价为0 B.2H——2个氢元素
C.2H2O——2个水分子 D.CuO——氧化铜
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法正确的是
A. 缺少维生素C易患夜盲症 B. 红磷和白磷是磷元素组成的不同单质
C. 蛋白质是最重要的供能物质 D. 点燃混有氮气的氢气会爆炸
相关试题

