【题目】用研磨成粉末的雄黄(化学式As4S4,化学名称为四硫化四砷)泡制的白酒或黄酒称为雄黄酒,是我国传统节日﹣端午节的饮品,也是我国古代人们在夏季除害灭病的主要消毒药剂:雄黄(化学式As4S4),可用作颜料、还原剂和药物等;砒霜(化学式As2O3)是一种剧毒物质,由于古代的生产技术落后,致使砒霜里混有少量的硫和硫化物.当银与砒霜中所含的硫接触时,就可发生化学反应,使银的表面生成一层黑色的硫化银.
(1)雄黄和雌黄两种物质中,硫元素的含量较高的是_________(填化学式).
(2)砒霜(化学式As2O3)的化学名称为_________.
(3)硫化银的化学式为________.
参考答案:
【答案】 As4S4 三氧化二砷 Ag2S
【解析】(1)雄黄(化学式As4S4)中硫元素的质量分数为:![]() ≈30%;砒霜(化学式As2O3)中硫元素的质量分数为:
≈30%;砒霜(化学式As2O3)中硫元素的质量分数为:![]() ≈24.2%,可见雄黄(化学式As4S4)中硫元素的质量分数大;故填:As4S4;
≈24.2%,可见雄黄(化学式As4S4)中硫元素的质量分数大;故填:As4S4;
(2)根据氧化物的命名方法可知,As2O3读作三氧化二砷;故填:三氧化二砷;
(3)在化合物中,银元素显+1价,硫元素显﹣2价,所以硫化银的化学式为Ag2S;故填:Ag2S。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室用KClO3和MnO2混合加热制氧气,并用排水法收集,有以下主要操作步骤:①装药品 ②加热 ③检查装置的气密性 ④用排水法收集氧气 ⑤停止加热 ⑥将导管从水槽中取出,正确的操作顺序是( )
A. ①②③④⑤⑥ B. ③①②④⑥⑤ C. ③①②④⑤⑥ D. ①③②④⑥⑤
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列典故中,从物质变化的角度分析,主要体现化学变化的是( )
A. 司马光砸缸 B. 凿壁偷光 C. 铁杵磨成针 D. 火烧赤壁
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质与空气混合,接触到明火,有发生爆炸危险的是( )
①氢气②汽油蒸气 ③面粉尘 ④棉尘 ⑤天然气
A.①②③④⑤ B.①②③ c.①②③⑤ D.①②
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知两种活动性不同的金属在能导电的溶液中接触可以形成原电池,从而加快化学反应速率.在实验室里,我们常用锌与稀硫酸反应来制取氢气(装置如图所示).
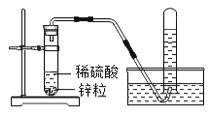
(1)实验室用锌与稀硫酸反应制取氢气的化学方程式为___________.
(2)实验室也可用锌与盐酸反应来制取氢气,但制得的氢气中往往含有HCl气体,若将制得的气体通过盛有NaOH溶液的洗气瓶,_______(填“能”或“不能”)得到纯净的氢气.
(3)点燃氢气之前,先要进行的操作是__________________.
(4)锌与稀硫酸反应时,加入某些盐溶液可使制取H2的速率加快,如__________溶液.
(5)图示装置,_____(填“能”或“不能”,药品可换)用来制取CO2气体.
-
科目: 来源: 题型:
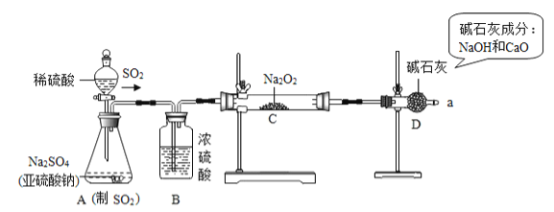
查看答案和解析>>【题目】某校九年级“我们爱化学”活动小组的同学,探究了过氧化钠(Na2O2)与二氧化硫(SO2)反应后所得固体产物的成分,过程如下:
【查阅资料】过氧化钠与二氧化硫反应的化学方程式为:2SO2+2Na2O2=2Na2SO3+O2,2Na2SO3+O2= 2Na2SO4;SO2能使品红溶液褪色.
【提出猜想】猜想1:固体成分为Na2SO3
猜想2:固体成分为Na2SO4
猜想3:固体成分为_________________
【实验探究】用如图所示的装置进行实验.打开A中分液漏斗的活塞,反应发生(产生足量的SO2)后,用带火星的木条检验从a处导出的气体,木条复燃.实验前称得Na2O2固体的质量为78g,充分反应后称得生成物固体的质量为134g.
【实验结论】
(1)A是制取SO2气体的装置,反应的化学方程式与实验室制取CO2的化学方程式类似,请写出A中发生反应的化学方程式:____________________________.
(2)由题中_________________________________________的实验现象,可推测猜想2是错误的.
(3)装置B的作用是_____________;装置D的作用是_____________________________.
(4)根据反应前后固体的质量,可计算出Na2SO3的质量为______g,Na2SO4的质量为______g.
【总结提升】
(1)若实验前称得Na2O2固体的质量为m1g,充分反应后称得生成物固体质量为m2g,则m2的取值范围是_____________________(用含m1的关系式表示).
(2)请另外设计一种实验方案,定性验证过氧化钠与二氧化硫反应后所得固体产物的成分:_________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国在2017年“世界环境日”(6月5日)确定的主题是“绿水青山,就是金山银山”.华雪与同学们积极参加了这一主题的活动,在老师的指导下,他们对一造纸厂排放的污水进行检测,发现其主要的污染物为NaOH.为了测定污水中NaOH的含量,他们首先把溶质质量分数为98%(密度1.84g/cm3)的浓硫酸20g,稀释为质量分数为10%的硫酸;然后取80g污水于烧杯中,逐滴加入10%的硫酸至49g时恰好完全反应(假定污水中的其它成分不与硫酸反应).请计算:
(1)把20g上述浓硫酸稀释为质量分数为10%的硫酸,需要水的质量是______g.
(2)污水中所含NaOH的质量分数是___________?(写出计算过程)
(3)取80g该污水于烧杯中放置几天后,若其中的氢氧化钠全部转化为碳酸钠.则此时应逐滴加入10%的硫酸______克才能使碳酸钠恰好完全变成硫酸钠.
相关试题

