【题目】下图是用绿色粉末A制取红色金属H的两种流程,其中白色固体F是一种常见的建筑材料,固体乙是目前用途最广、产量最高的金属。
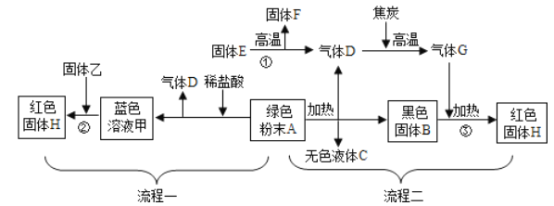
请回答下列问题:
⑴写出有关物质的化学式:B____;乙____。
⑵写出转化①的化学方程式______________________, F的其他用途有_______。
⑶转化②的过程中生成红色固体H的化学方程式为__________________;如果在转化②中同时产生气体,则原因是(用化学方程式说明)_____________________。
⑷转化③发生的反应方程式为_________________。
⑸如果在实验室中由物质A制取H,上述两种流程中,操作比较简便的是流程______。
参考答案:
【答案】 CuO Fe CaCO3![]() CaO+ CO2↑ 干燥剂 Fe+CuCl2===Cu+ FeCl2 Fe +2HCl== FeCl2 +H2 ↑ CuO+CO
CaO+ CO2↑ 干燥剂 Fe+CuCl2===Cu+ FeCl2 Fe +2HCl== FeCl2 +H2 ↑ CuO+CO![]() Cu+ CO2↑ 一
Cu+ CO2↑ 一
【解析】(1)绿色粉末A制取红色金属H,实际是碱式碳酸铜制取铜的过程;碱式碳酸铜在加热的条件下生成氧化铜和水和二氧化碳,因此黑色固体B是氧化铜;固体乙是目前用途最广、产量最高的金属,因此乙是铁;故填:CuO、Fe;(2)碳酸钙高温煅烧生成氧化钙和二氧化碳,化学方程式为:CaCO3![]() CaO+ CO2↑;因此E是碳酸钙,F是氧化钙,D是二氧化碳,氧化钙可以做干燥剂,也可以用来做消毒剂等;(3)铁与氯化铜反应生成铜和氯化亚铁,如果在转化②中同时产生气体,则说明盐酸过量,铁和盐酸反应生成氯化亚铁和氢气,化学方程式为:Fe+CuCl2═Cu+FeCl2;Fe+2HCl═H2↑+FeCl2;(4)一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,化学方程式为:CO+CuO
CaO+ CO2↑;因此E是碳酸钙,F是氧化钙,D是二氧化碳,氧化钙可以做干燥剂,也可以用来做消毒剂等;(3)铁与氯化铜反应生成铜和氯化亚铁,如果在转化②中同时产生气体,则说明盐酸过量,铁和盐酸反应生成氯化亚铁和氢气,化学方程式为:Fe+CuCl2═Cu+FeCl2;Fe+2HCl═H2↑+FeCl2;(4)一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,化学方程式为:CO+CuO![]() Cu+CO2;(5)如果在实验室中由物质A制取H,操作一比较简便。
Cu+CO2;(5)如果在实验室中由物质A制取H,操作一比较简便。
-
科目: 来源: 题型:
查看答案和解析>>【题目】利用下图所示装置,探究可燃物的燃烧条件。
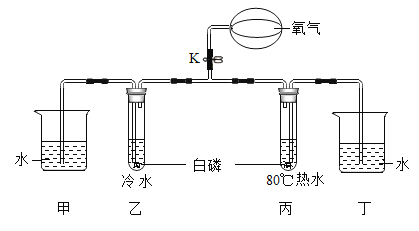
已知:白磷的着火点为40℃
(1)白磷燃烧的化学方程式为________。
(2)打开K,通入氧气,观察到试管中液面下降,原因是________。
(3)对比乙、丙中的实验现象,可知可燃物燃烧的条件之一是________;实验过程中,能说明可燃物燃烧的另一个条件的实验现象是________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】燃料燃烧所产生的热量给生活与生产带来了很大的便利,但燃烧不当也会造成极大的损害。
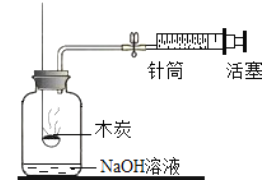
(1)燃烧不完全燃烧既浪费资源,产生的气体又对环境造成污染。为研究影响物质燃烧的因素,现设计如下图所示实验:
将燃烧匙内小木炭块灼烧至红热后,立即伸入集气瓶内,并塞紧橡皮塞。将注射器内氧气迅速推入集气瓶内,观察到木炭发白光。该实验说明燃烧的剧烈程度与_______有关。燃烧的剧烈程度还与可燃物与氧气的接触面积有关,如__________(举一日常生活实例),说明__________。
(2)小明、小刚同学在研究灭火的原理时,进行了如下实验:分别在两个小铁盒中倒入少量植物油并点燃,小明用坩埚钳把小铁盒放在冰水共存的水面上,观察到火焰立即熄灭,该实验证明了灭火的原理是_________,小刚同学将一块湿抹布盖在小铁盒上,火焰也立即熄灭,他依据的灭火原理是_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(6分)小明同学为了测定市面销售的某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:
①在三个烧杯中分别加入11.0g样品及足量的水配成溶液;
②向三个烧杯中分别加入一定质量的10.0%氯化钙溶液;
③将充分反应后生成的沉淀过滤、洗涤、干燥,并称量得到的白色固体。
实验所得数据见下表,请你分析并进行有关计算:
烧杯Ⅰ
烧杯Ⅱ
烧杯Ⅲ
加入10.0%氯化钙溶液的质量(g)
55.5
120.0
150.0
白色固体的质量(g)
5.0
10.0
10.0
(1)样品中碳酸钠的质量分数是多少?(结果精确到0.1%)
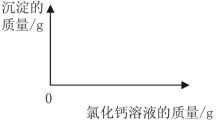
(2)在下图中绘制出白色沉淀与加入氯化钙溶液的质量关系图(图上要注明白色沉淀、氯化钙溶液的相关质量)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示溶液),他们对此产生了兴趣。
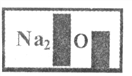
[提出问题]这瓶溶液究竟是什么?
经过询问实验老师平时的药品保管得知,这瓶无色溶液应该是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中的某一种。为了确定该药品,他们首先进行了理论分析:
(1)小明根据标签上的组成元素认为一定不可能是______。
(2)小英提出,碳酸氢钠、硝酸钠也不可能,你认为她的依据是_______。
为了确定该溶液究竟是剩余两种盐的哪一种,他们设计了如下实验。
[设计实验]
实验操作
实验现象
取少量样品于试管中,慢慢滴加BaCl2溶液,静置一段时间,倾去上层清液,向沉淀中继续滴加稀盐酸
先出现白色沉淀,后产生大量气泡
[实验结论]
(3) 该瓶无色溶液是_______。生成白色沉淀过程的化学方程式是________。
[实验反思]
(4)小强认为上述设计实验还可简化,仍能达到目的。小强的实验操作是______。经查阅资料得知上述五种盐里碳酸钠、碳酸氢钠的溶液呈碱性,其余三种盐的溶液呈中性,请你再设计一种实验方法,确定该溶液究竟是哪种盐。简述实验操作和现象____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙两种固体物质的溶解度曲线如下图所示。现将两支分别装有甲、乙两物质饱和溶液的试管(底部均有少量未溶解的固体)浸入盛有水的烧杯中,再向烧杯中加入一定量浓硫酸。
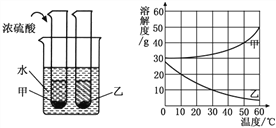
(1)50℃时,甲物质的溶解度是_____。
(2)30℃时,甲、乙两种物质的溶解度大小顺序是____________。
(3)烧杯中加入浓硫酸后,甲、乙两试管中固体量的变化是____________________。除了加浓硫酸外,还可以加__________物质,也会发生这样的变化。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某研究小组用下图所示装置,探究能否用镁条代替红磷测定空气中氧气含量。
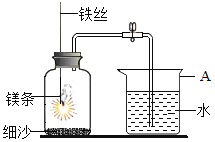
实验前,小组成员提出了不同的猜想。
【猜想与假设】
猜想1:可以代替,因为镁条与氧气反应后不会产生气体
猜想2:不能代替,查阅资料知金属镁很活泼,可能会与空气中的氮气反应
【进行实验】
步骤
实验操作
实验现象
Ⅰ
组装好装置后,打开止水夹,手捂集气瓶,一段时间后,松开手
烧杯中导管口有气泡冒出,松手后,烧杯中导管末端有一段液柱
Ⅱ
关闭止水夹,点燃镁条,迅速伸入集气瓶中,塞好塞子
镁条燃烧,放出大量热,发出耀眼白光,生成大量白烟,剩余固体为白色带状物
Ⅲ
冷却至室温,打开止水夹
烧杯中水从导管进入集气瓶中,体积约为集气瓶体积的2/5
【解释与结论】
(1)Mg与氧气反应的化学方程式为_________。
(2)步骤Ⅰ说明装置的气密性_________。
(3)步骤Ⅱ中,关闭止水夹的目的是_________。
(4)推测猜想2成立的现象证据是_________。
【反思与评价】
(5)该小组认为,即使步骤Ⅲ中水的体积恰好占集气瓶体积的1/5,也不能说明猜想1成立,理由是_________。
(6)小组中同学对镁条与瓶中气体的反应提出了进一步的猜想:甲同学认为镁条先与O2反应,乙同学认为镁条先与N2反应。为进一步检验他们的猜想,可以进行的实验操作是:取少量镁条,点燃后迅速放入盛有空气的集气瓶中,待镁条熄灭后,________。
相关试题

