【题目】甲、乙两种固体物质的溶解度曲线如下图所示。现将两支分别装有甲、乙两物质饱和溶液的试管(底部均有少量未溶解的固体)浸入盛有水的烧杯中,再向烧杯中加入一定量浓硫酸。
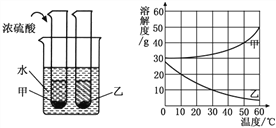
(1)50℃时,甲物质的溶解度是_____。
(2)30℃时,甲、乙两种物质的溶解度大小顺序是____________。
(3)烧杯中加入浓硫酸后,甲、乙两试管中固体量的变化是____________________。除了加浓硫酸外,还可以加__________物质,也会发生这样的变化。
参考答案:
【答案】 40g 甲大于乙(S甲﹥S乙) 甲减少乙增多 氢氧化钠或生石灰(答案合理即可)
【解析】由甲、乙两种固体物质的溶解度曲线图:(1)50℃时,甲物质的溶解度是40g;(2)30℃时,甲、乙两种物质的溶解度大小顺序是甲>乙;(3)由图可知:甲、乙两种固体物质的溶解度曲线随温度变化的趋势;由因为浓硫酸溶于水放热,故可知烧杯中加入浓硫酸后,甲、乙两试管中固体量的变化是甲减少,乙增多。除了加浓硫酸外,还可以加NaOH(或CaO)等在溶解于水或者和水反应过程中释放热量的固体物质,也会发生这样的变化(同样的结果,不同的原理)。
-
科目: 来源: 题型:
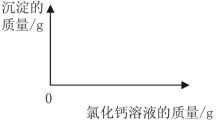
查看答案和解析>>【题目】(6分)小明同学为了测定市面销售的某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:
①在三个烧杯中分别加入11.0g样品及足量的水配成溶液;
②向三个烧杯中分别加入一定质量的10.0%氯化钙溶液;
③将充分反应后生成的沉淀过滤、洗涤、干燥,并称量得到的白色固体。
实验所得数据见下表,请你分析并进行有关计算:
烧杯Ⅰ
烧杯Ⅱ
烧杯Ⅲ
加入10.0%氯化钙溶液的质量(g)
55.5
120.0
150.0
白色固体的质量(g)
5.0
10.0
10.0
(1)样品中碳酸钠的质量分数是多少?(结果精确到0.1%)
(2)在下图中绘制出白色沉淀与加入氯化钙溶液的质量关系图(图上要注明白色沉淀、氯化钙溶液的相关质量)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是用绿色粉末A制取红色金属H的两种流程,其中白色固体F是一种常见的建筑材料,固体乙是目前用途最广、产量最高的金属。
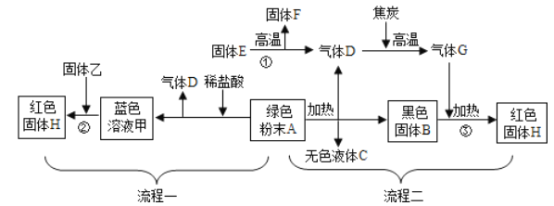
请回答下列问题:
⑴写出有关物质的化学式:B____;乙____。
⑵写出转化①的化学方程式______________________, F的其他用途有_______。
⑶转化②的过程中生成红色固体H的化学方程式为__________________;如果在转化②中同时产生气体,则原因是(用化学方程式说明)_____________________。
⑷转化③发生的反应方程式为_________________。
⑸如果在实验室中由物质A制取H,上述两种流程中,操作比较简便的是流程______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示溶液),他们对此产生了兴趣。
[提出问题]这瓶溶液究竟是什么?
经过询问实验老师平时的药品保管得知,这瓶无色溶液应该是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中的某一种。为了确定该药品,他们首先进行了理论分析:
(1)小明根据标签上的组成元素认为一定不可能是______。
(2)小英提出,碳酸氢钠、硝酸钠也不可能,你认为她的依据是_______。
为了确定该溶液究竟是剩余两种盐的哪一种,他们设计了如下实验。
[设计实验]
实验操作
实验现象
取少量样品于试管中,慢慢滴加BaCl2溶液,静置一段时间,倾去上层清液,向沉淀中继续滴加稀盐酸
先出现白色沉淀,后产生大量气泡
[实验结论]
(3) 该瓶无色溶液是_______。生成白色沉淀过程的化学方程式是________。
[实验反思]
(4)小强认为上述设计实验还可简化,仍能达到目的。小强的实验操作是______。经查阅资料得知上述五种盐里碳酸钠、碳酸氢钠的溶液呈碱性,其余三种盐的溶液呈中性,请你再设计一种实验方法,确定该溶液究竟是哪种盐。简述实验操作和现象____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某研究小组用下图所示装置,探究能否用镁条代替红磷测定空气中氧气含量。
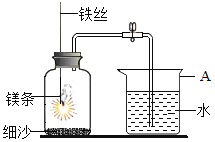
实验前,小组成员提出了不同的猜想。
【猜想与假设】
猜想1:可以代替,因为镁条与氧气反应后不会产生气体
猜想2:不能代替,查阅资料知金属镁很活泼,可能会与空气中的氮气反应
【进行实验】
步骤
实验操作
实验现象
Ⅰ
组装好装置后,打开止水夹,手捂集气瓶,一段时间后,松开手
烧杯中导管口有气泡冒出,松手后,烧杯中导管末端有一段液柱
Ⅱ
关闭止水夹,点燃镁条,迅速伸入集气瓶中,塞好塞子
镁条燃烧,放出大量热,发出耀眼白光,生成大量白烟,剩余固体为白色带状物
Ⅲ
冷却至室温,打开止水夹
烧杯中水从导管进入集气瓶中,体积约为集气瓶体积的2/5
【解释与结论】
(1)Mg与氧气反应的化学方程式为_________。
(2)步骤Ⅰ说明装置的气密性_________。
(3)步骤Ⅱ中,关闭止水夹的目的是_________。
(4)推测猜想2成立的现象证据是_________。
【反思与评价】
(5)该小组认为,即使步骤Ⅲ中水的体积恰好占集气瓶体积的1/5,也不能说明猜想1成立,理由是_________。
(6)小组中同学对镁条与瓶中气体的反应提出了进一步的猜想:甲同学认为镁条先与O2反应,乙同学认为镁条先与N2反应。为进一步检验他们的猜想,可以进行的实验操作是:取少量镁条,点燃后迅速放入盛有空气的集气瓶中,待镁条熄灭后,________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】“舌尖上的中国”在央视上的热播让厨房再次成为人们施展厨艺的舞台。大多数厨师有个工作经验:炒菜时,又加料酒又加醋,可使菜变得香美可口,原因是醋中的乙酸与料酒中的乙醇生成乙酸乙酯。下表中是几种常见的酯,请完成下列问题:
酯的名称
甲酸甲酯
甲酸乙酯
乙酸甲酯
乙酸乙酯
化学式
C2H4O2
C3H6O2
C3H6O2
X
(1)甲酸甲酯(C2H4O2)中碳元素、氢元素、氧元素的质量比为 _______;
(2)甲酸乙酯(C3H6O2)中碳元素的质量分数为_______(计算结果精确到0.1%);
(3)比较归纳是学习化学的重要方法,据表推测X的化学式为________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】豆腐是人们喜爱的食物,营养丰富,能为人体提供所需的多种氨基酸,其中含量最多的是亮氨酸(C6H13NO2),关于亮氨酸的说法正确的是( )
A. 亮氨酸是氧化物
B. 亮氨酸中碳元素的质量分数为27.3%
C. 一个亮氨酸分子由22个原子构成
D. 亮氨酸中碳、氢、氮、氧四种元素的质量比为6:13:1:2
相关试题

