【题目】如图所示的实验能验证水的组成:
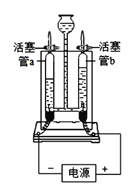
(1)接通直流电源一段时间后,玻璃管b内产生的气体是_________,该管内产生约4g气体时,玻璃管a内产生约_______g气体。
(2)上述实验说明水是由_____________组成的。
(3)该实验中,往电解器玻璃管里加满含有酚酞的硫酸钠溶液(硫酸钠只增强导电性,不发生反应)。在实验过程中,观察到管b电极附近的溶液迅速变红,则该处溶液呈___________(填“酸”“碱”或“中”)性。电解后,待溶液混合均匀后测得溶液的pH=7,说明电解时管a电极附近的溶液呈________(填“酸”“碱”或“中”)性。
(4)该实验中,若水中加入少量硫酸以增强导电性,硫酸不发生反应,则电解后溶液的pH_________(填“增大”“减小”或“不变”)。
参考答案:
【答案】 氧气 0.5 氢元素和氧元素 碱 酸 减小
【解析】本题考查了电解水实验,溶液的酸碱性与pH值的关系。
(1)玻璃管b连接电源的正极,产生的气体体积较小,产生的是氧气;则玻璃管a中产生的是氢气,由化学方程式2H2O ![]() 2H2↑+O2↑可知,生成氢气与氧气的质量比为4:32=1:8,若b管内产生约4g氧气时,玻璃管a内产生约0.5g氢气;
2H2↑+O2↑可知,生成氢气与氧气的质量比为4:32=1:8,若b管内产生约4g氧气时,玻璃管a内产生约0.5g氢气;
(2)电解水生成氢气与氧气,由质量守恒定律可知,水是由氢元素与氧元素组成的;
(3)酚酞遇碱性溶液变红色。在实验过程中,观察到管b电极附近的溶液迅速变红,则该处溶液呈碱性,电解后,待溶液混合均匀后测得溶液的pH=7,说明电解时管a电极附近的溶液呈酸性;
(4)电解水生成氢气和氧,水的质量变小,硫酸质量不变,酸性增强,溶液的pH减小。
-
科目: 来源: 题型:
查看答案和解析>>【题目】为探究物质的燃烧条件,某同学进行了如下图所示的实验。下列说法正确的是
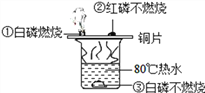
A. 现象①③说明物质燃烧需要达到一定的温度
B. 现象②说明红磷不是可燃物
C. 现象①②说明白磷的着火点比红磷低
D. 现象③说明白磷的着火点高于80℃
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列图像能正确反映其对应操作的是
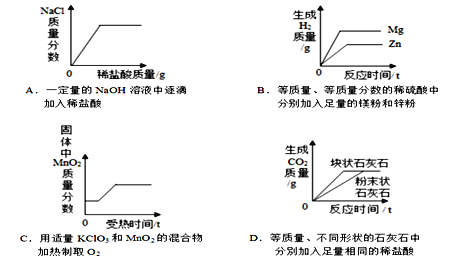
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】用化学用语填空。
(1)2个氢原子_____________;
(2)氖气_____________;
(3)4个亚铁离子_____________;
(4)N2O5中氮元素的化合价_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】归纳总结是学习化学的重要方法,小明同学用图一总结了盐酸的四条化学性质(即盐酸与四类物质能够发生化学反应)。
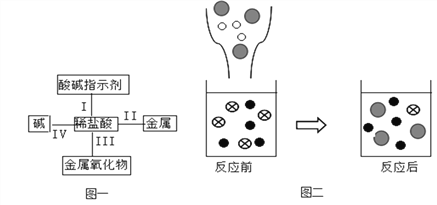
(1)验证性质I,小明将石蕊溶液滴入稀盐酸中,现象是________________。
(2)验证性质II,能与稀盐酸反应的物质是______________(填序号)。
A.Mg B.Fe2O3 C.Al D.Au
(3)验证性质IV,小明往氢氧化钾溶液中滴加稀盐酸。
①该反应的化学方程式是_____________________;
②图二表示该反应前后溶液中存在的主要离子,请写出下列图形代表的离子(填离子符号):
 _____________,
_____________, ______________;
______________;③从图二中可以看出,反应后的溶液pH______7(填 “>”、“<”或“=”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题:
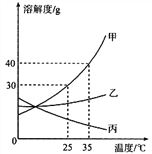
(1)25℃时,将2g甲固体加入到5g水中,充分溶解并恢复到原温度后,得到溶液的质量为__________g。
(2)要使35℃时接近饱和的丙溶液变成该温度下的饱和溶液,可采用的一种方法是_________。
(3)现有操作步骤:A.溶解B.过滤C.降温结晶D.加热浓缩。若甲固体中含有少量乙,则提纯甲的操作步骤是___________。(填字母序号)
(4)若将35℃时甲的饱和溶液降温到25℃,则其溶液的溶质质量分数会__________。(填“变大”“变小”或“不变”)
-
科目: 来源: 题型:
查看答案和解析>>【题目】以钛铁矿(主要成分为FeTiO3,同时含有少量的Fe2O3 、FeO等)为原料制TiO2,再由TiO2制金属Ti的工艺流程如下:
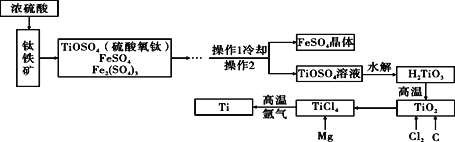
(1)写出由TiCl4制得Ti的化学反应方程式(已知该反应为置换反应): ___________。
(2)由H2TiO3制得TiO2的反应与碳酸分解类似,写出该反应方程式: ___________。
(3)工艺流程中,水解属于_________变化。(填“物理”或“化学”)
(4)操作2的名称是________________。
(5)TiO2可与焦炭、氯气在高温下反应,该反应为TiO2+2C+2Cl2==TiCl4+2X,则物质X的化学式为__________。
相关试题

