【题目】以钛铁矿(主要成分为FeTiO3,同时含有少量的Fe2O3 、FeO等)为原料制TiO2,再由TiO2制金属Ti的工艺流程如下:
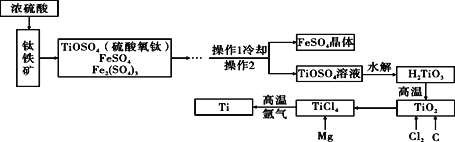
(1)写出由TiCl4制得Ti的化学反应方程式(已知该反应为置换反应): ___________。
(2)由H2TiO3制得TiO2的反应与碳酸分解类似,写出该反应方程式: ___________。
(3)工艺流程中,水解属于_________变化。(填“物理”或“化学”)
(4)操作2的名称是________________。
(5)TiO2可与焦炭、氯气在高温下反应,该反应为TiO2+2C+2Cl2==TiCl4+2X,则物质X的化学式为__________。
参考答案:
【答案】 2Mg + TiCl4 ![]() 2MgCl2 + Ti H2TiO3
2MgCl2 + Ti H2TiO3 ![]() H2O +TiO2 化学 过滤 CO
H2O +TiO2 化学 过滤 CO
【解析】本题考查了化学变化和物理变化的判别,质量守恒定律及其应用,化学方程式的书写等。
(1)四氯化钛和镁在高温的条件下发生置换反应,生成钛和氯化镁,化学方程式为:2Mg + TiCl4 ![]() 2MgCl2 + Ti;
2MgCl2 + Ti;
(2)钛酸分解生成二氧化钛和水,化学方程式为:H2TiO3 ![]() H2O +TiO2;
H2O +TiO2;
(3)工艺流程中,水解过程中有新物质生成,属于化学变化;
(4)过滤可以将不溶性固体从溶液中分离出来,所以操作2的名称是过滤;
(5)反应前,有1个钛原子,2个氧原子,2个碳原子,4个氯原子,生成物中有1个钛原子,4个氯原子和2X,根据质量守恒可知,X是CO。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示的实验能验证水的组成:
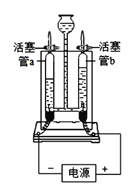
(1)接通直流电源一段时间后,玻璃管b内产生的气体是_________,该管内产生约4g气体时,玻璃管a内产生约_______g气体。
(2)上述实验说明水是由_____________组成的。
(3)该实验中,往电解器玻璃管里加满含有酚酞的硫酸钠溶液(硫酸钠只增强导电性,不发生反应)。在实验过程中,观察到管b电极附近的溶液迅速变红,则该处溶液呈___________(填“酸”“碱”或“中”)性。电解后,待溶液混合均匀后测得溶液的pH=7,说明电解时管a电极附近的溶液呈________(填“酸”“碱”或“中”)性。
(4)该实验中,若水中加入少量硫酸以增强导电性,硫酸不发生反应,则电解后溶液的pH_________(填“增大”“减小”或“不变”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】归纳总结是学习化学的重要方法,小明同学用图一总结了盐酸的四条化学性质(即盐酸与四类物质能够发生化学反应)。
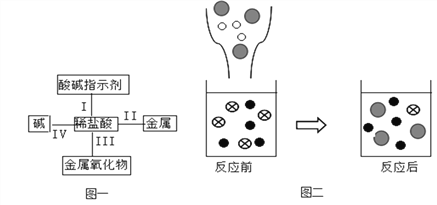
(1)验证性质I,小明将石蕊溶液滴入稀盐酸中,现象是________________。
(2)验证性质II,能与稀盐酸反应的物质是______________(填序号)。
A.Mg B.Fe2O3 C.Al D.Au
(3)验证性质IV,小明往氢氧化钾溶液中滴加稀盐酸。
①该反应的化学方程式是_____________________;
②图二表示该反应前后溶液中存在的主要离子,请写出下列图形代表的离子(填离子符号):
 _____________,
_____________, ______________;
______________;③从图二中可以看出,反应后的溶液pH______7(填 “>”、“<”或“=”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题:
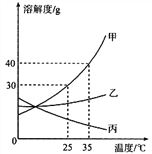
(1)25℃时,将2g甲固体加入到5g水中,充分溶解并恢复到原温度后,得到溶液的质量为__________g。
(2)要使35℃时接近饱和的丙溶液变成该温度下的饱和溶液,可采用的一种方法是_________。
(3)现有操作步骤:A.溶解B.过滤C.降温结晶D.加热浓缩。若甲固体中含有少量乙,则提纯甲的操作步骤是___________。(填字母序号)
(4)若将35℃时甲的饱和溶液降温到25℃,则其溶液的溶质质量分数会__________。(填“变大”“变小”或“不变”)
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下列装置图,回答问题:
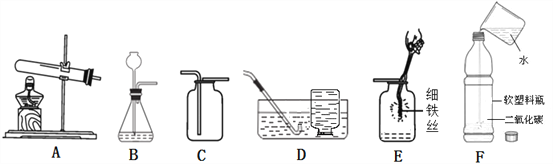
(1)用高锰酸钾制取氧气,选用的发生装置是_____(填序号),为防止高锰酸钾粉末进入导管,该装置需做一点改进的是_________,若用D装置收集氧气,当观察到_________时,便可开始收集。
(2)实验室制取二氧化碳应选用的一组装置是____________________(填序号),反应的化学方程式是_____________。图G是某同学利用报废试管设计的制二氧化碳的发生装置,该设计除了废物利用的优点外,请另写一个优点:______________。
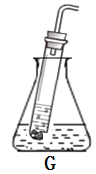
(3)用收集的氧气完成图E铁丝燃烧的实验,集气瓶中预先放少量水的原因是________;如图F向装满CO2软塑料瓶注入约
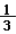 体积的水,立即旋紧瓶塞,振荡。观察到的现象是________________。
体积的水,立即旋紧瓶塞,振荡。观察到的现象是________________。 -
科目: 来源: 题型:
查看答案和解析>>【题目】在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和氧化铁粉中的一种或两种。同学们为了确定该粉末的成分,进行如下探究:
【提出问题】假设l:红色粉末是铜粉;假设2:红色粉末是氧化铁粉;假设3:红色粉末是铜粉和氧化铁粉。
【设计实验方案】同学们对实验作了如下设想和分析:取5g红色粉末放入硬质玻璃管中,通入一氧化碳片刻后加热至充分反应(实验装置如下图)。
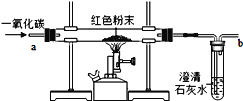
【进行实验】通过实验及分析。若确认假设3成立,则硬质玻璃管中出现的现象是____________。
【反思与评价】(1)实验过程中,硬质玻璃管内发生的化学反应方程式是_________;
(2)实验时通入一氧化碳片刻后再加热的原因是______;
(3)从环保角度看,上面的实验装置有不足之处,请你对该装置进行改进,具体措施是________;
(4)若得到铁的质量为2.24g,则原来混合物中氧化铁粉末的质量分数为_____________。
【知识拓展】实验结束后得到了铜和铁,现为了进一步探究铁和铜的金属活动性强弱,还需要选择的试剂______________(填序号)。
A.碳酸钠溶液 B.稀盐酸 C.氯化锌溶液 D.硝酸铜溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是某化学反应的微观模型,“
 ”、“
”、“ ”分别表示不同元素的原子,下列各项中对图示模型理解正确的是( )
”分别表示不同元素的原子,下列各项中对图示模型理解正确的是( )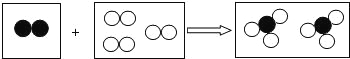
A.该反应属于分解反应
B.反应中共有两种元素参加
C.反应物和生成物中只有一种单质
D.参加反应的两种物质分子个数之比为2:3
相关试题

