【题目】化学用语是学习化学的重要工具。
(1)写出下列微粒的化学符号:
①镁离子 。 ②二氧化氮分子 。
③5个硅原子 。 ④硝酸分子 。
(2)用下列字母序号填空:
a.硫酸铜 b.氯化钠 c.氮气 d.石墨
① 用作调味品和防腐剂。 ② 用作粮食保护气。
③ 用于配制波尔多液。 ④ 用于生产铅笔芯。
(3)写出下列反应的化学方程式:
①盐酸与氢氧化钠溶液反应 。
②铝与氧气反应 。
③一氧化碳与氧化铁反应 。
④用高锰酸钾制取氧气 。
参考答案:
【答案】
(1)①Mg2+ ②NO2 ③5Si ④HNO3
(2)①b ②c ③a ④d
(3)①HCl+NaOH=NaCl+H2O
②4Al+3O2![]() 2Al2O3
2Al2O3
③3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
④2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
【解析】
试题分析:
(1)①离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。故镁离子可表示为:Mg2+;
②据分子的表示方法:正确书写物质的化学式,二氧化氮分子是多原子分子,氮为+4价,氧为﹣2价,氧化物中氧元素在后,二氧化氮分子可表示为:NO2;
③原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字。所以5个硅原子,就可表示为:5Si;
④据分子的表示方法:正确书写物质的化学式,硝酸分子可表示为:HNO3;
(2)①氯化钠常用作调味品和防腐剂;②氮气化学性质稳定,常用作粮食保护气;
③硫酸铜用于配制波尔多液;④石墨质软,常用于生产铅笔芯;
(3)①盐酸与氢氧化钠溶液反应生成氯化钠和水,反应的化学方程式为:HCl+NaOH=NaCl+H2O;
②铝与氧气在点燃的条件下反应,生成氧化铝(Al2O3),反应的化学方程式为:4Al+3O2![]() 2Al2O3。
2Al2O3。
③一氧化碳与氧化铁在高温的条件下,生成铁和二氧化碳,配平即可。反应的化学方程式为:3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
④高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,反应的化学方程式是2KMnO4![]() K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验操作中正确的是
A. 将实验用剩余的药品放回原试剂瓶 B. 给烧杯加热时垫上石棉网
C. 向燃着的酒精灯里添加酒精 D. 给盛满液体的试管直接加热
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学与生活密切相关。
(1)如表为某女士一天的营养摄入量与推荐摄入量的比较(部分):
项目
摄入量
推荐摄入量
蛋白质(g)
72.9
65
脂肪(g)
65.1
48.2~72.3
维生素C(mg)
176
100
钙(mg)
807
800
铁(mg)
21
20
硒(mg)
0.037
0.05
①蛋白质、油脂和葡萄糖中属于高分子化合物的是 。
②钙、铁、硒三种元素中, 在人体内含量最高(填元素名称,下同),缺 易得贫血症,该女士摄入的 没有达到推荐摄入量。
(2)制造汽车使用了镁铝合金、玻璃钢、聚氯乙烯等材料。
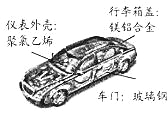
①上述材料中属于金属材料的是 ,属于合成材料的是 ,属于复合材料的是 。
②将镁铝合金与铝片相互刻画,在铝片表面留下明显划痕,说明镁铝合金的硬度 铝的硬度(填“大于”或“小于”).
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室制备二氧化碳气体的常用方法是
A.用石灰石与稀硫酸反应 B.点燃木炭
C.用石灰石与稀盐酸反应 D.碳酸分解
-
科目: 来源: 题型:
查看答案和解析>>【题目】水是生命之源,下列关于水的说法不正确的是( )
A.水分解生成了氢气和氧气 B.水污染与人类活动紧密相关
C.水分子保持水的化学性质 D.水分子由氢分子和氧原子构成
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学在确定一种气体的实验室制法时,不需要考虑的是
A.反应所需条件和药品的状态 B.气体的性质
C.气体的验满方法 D.气体的用途
-
科目: 来源: 题型:
查看答案和解析>>【题目】CaCO3在生产生活中有广泛的用途。
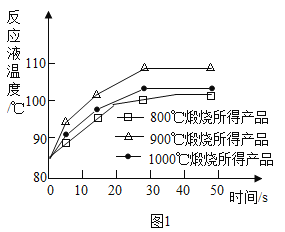
(1)煅烧石灰石可制得活性CaO,反应的化学方程式为___________________。为测定不同煅烧温度对CaO活性的影响,取石灰石样品分为三等分,在同一设备中分别于800℃、900℃和1000℃条件下煅烧,所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如图1所示。可知:CaO与水反应会_____热量(填“放出”或“吸收”);上述温度中,___℃煅烧所得CaO活性最高.要得出正确结论,煅烧时还需控制的条件是____________。
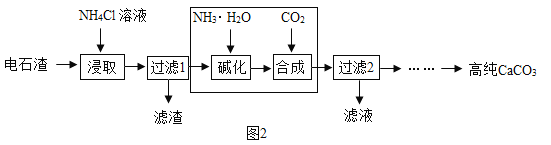
(2)以电石渣[主要成分为Ca(OH)2,还含有少量MgO等杂志]为原料制备高纯CaCO3的流程如下:
①如图3为NH4Cl浓度对钙、镁浸出率的影响(浸出率=
 ×100%)。
×100%)。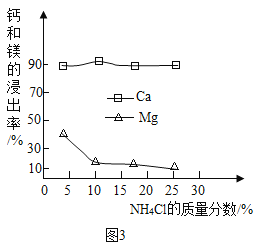
可知:较适宜的NH4Cl溶液的质量分数为_______;浸取时主要反应的化学方程式为_________________。
②流程中虚线内部分若改用______溶液(填化学式),可一步得到与原流程完全相同的生成物。
③流程中虚线内部若改用Na2CO3溶液,也能得到高纯CaCO3,试从生物的角度分析原流程的优点:a.NH3可循环利用;b._______________。
相关试题

