【题目】CaCO3在生产生活中有广泛的用途。
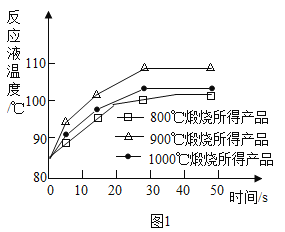
(1)煅烧石灰石可制得活性CaO,反应的化学方程式为___________________。为测定不同煅烧温度对CaO活性的影响,取石灰石样品分为三等分,在同一设备中分别于800℃、900℃和1000℃条件下煅烧,所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如图1所示。可知:CaO与水反应会_____热量(填“放出”或“吸收”);上述温度中,___℃煅烧所得CaO活性最高.要得出正确结论,煅烧时还需控制的条件是____________。
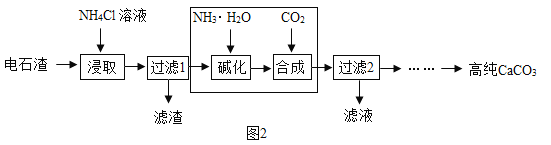
(2)以电石渣[主要成分为Ca(OH)2,还含有少量MgO等杂志]为原料制备高纯CaCO3的流程如下:
①如图3为NH4Cl浓度对钙、镁浸出率的影响(浸出率=![]() ×100%)。
×100%)。
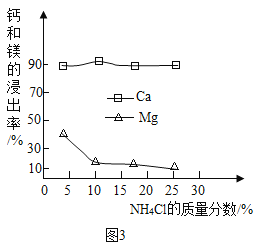
可知:较适宜的NH4Cl溶液的质量分数为_______;浸取时主要反应的化学方程式为_________________。
②流程中虚线内部分若改用______溶液(填化学式),可一步得到与原流程完全相同的生成物。
③流程中虚线内部若改用Na2CO3溶液,也能得到高纯CaCO3,试从生物的角度分析原流程的优点:a.NH3可循环利用;b._______________。
参考答案:
【答案】 CaCO3![]() CaO+CO2↑ 放出 900 氧化钙的质量 10% 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O NH4HCO3 可以得到化工产品氯化钠
CaO+CO2↑ 放出 900 氧化钙的质量 10% 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O NH4HCO3 可以得到化工产品氯化钠
【解析】试题分析:
(1)碳酸钙在高温的条件下生成氧化钙和二氧化碳,化学方程式为:CaCO3![]() CaO+CO2↑,氧化钙和水反应生成氢氧化钙,放出热量,通过分析表中的数据可知,900℃时所得CaO活性最高,要得出正确结论,煅烧时还需控制的条件是氧化钙的质量;
CaO+CO2↑,氧化钙和水反应生成氢氧化钙,放出热量,通过分析表中的数据可知,900℃时所得CaO活性最高,要得出正确结论,煅烧时还需控制的条件是氧化钙的质量;
(2)①通过分析图象中氯化铵浸出钙离子的质量分数可知,较适宜的NH4Cl溶液的质量分数为10%,氯化铵和氢氧化钙反应生成氯化钙、氨气和水,所以浸取时主要反应的化学方程式为:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;
②图中的流程分析可知,碳酸氢铵和氨水、二氧化碳所起的作用是相同的,所以流程中虚线内部分若改用NH4HCO3溶液;
③流程中虚线内部若改用Na2CO3溶液,也能得到高纯CaCO3,除了氨气可以循环使用,可以得到化工产品氯化钠。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学用语是学习化学的重要工具。
(1)写出下列微粒的化学符号:
①镁离子 。 ②二氧化氮分子 。
③5个硅原子 。 ④硝酸分子 。
(2)用下列字母序号填空:
a.硫酸铜 b.氯化钠 c.氮气 d.石墨
① 用作调味品和防腐剂。 ② 用作粮食保护气。
③ 用于配制波尔多液。 ④ 用于生产铅笔芯。
(3)写出下列反应的化学方程式:
①盐酸与氢氧化钠溶液反应 。
②铝与氧气反应 。
③一氧化碳与氧化铁反应 。
④用高锰酸钾制取氧气 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】水是生命之源,下列关于水的说法不正确的是( )
A.水分解生成了氢气和氧气 B.水污染与人类活动紧密相关
C.水分子保持水的化学性质 D.水分子由氢分子和氧原子构成
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学在确定一种气体的实验室制法时,不需要考虑的是
A.反应所需条件和药品的状态 B.气体的性质
C.气体的验满方法 D.气体的用途
-
科目: 来源: 题型:
查看答案和解析>>【题目】CO2的资源化利用日趋成为研究热点。
(1)某小组查阅资料发现:①CO2与H2能在催化剂表面反应生成CH4与H2O;②CH4在高温下能与CuO反应。为探究上述反应,设计如下装置:
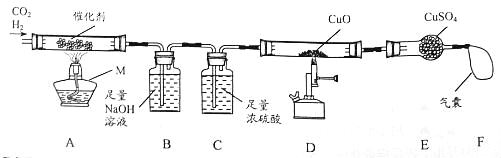
①仪器M的名称是 ,装置B中反应的化学方程式为 。
②设计装置C的目的是 ,若要证明D中有CO2生成,则需在E、F之间增加盛有 溶液的洗气瓶。
③一段时间后,装置D中黑色固体变红,E中白色固体变蓝,该小组由此得出结论:以上实验证明CH4在高温条件下能与CuO反应。你是否同意他们的结论? (填“同意”或“不同意”),理由是 。
(2)CH4、乙炔(C2H2)和丙烷(CH3H8)都能在空气中燃烧,但是仅C2H2燃烧时有浓烟。试从物质组成的角度分析其燃烧现象不同的原因是: 。CH4燃料电池具有洁净、高效的特点,其工作时主要是将 能转化为电能。
-
科目: 来源: 题型:
查看答案和解析>>【题目】核电荷数为1~18的x、y两元素,x元素原子的次外层电子数与最外层电子数的差等于5;y元素比x元素的原子多4个电子,则y与x可能形成的化合物是( )
A.YX3 B.XY3 C.X3Y D.X2Y
-
科目: 来源: 题型:
查看答案和解析>>【题目】硫酸铜在纺织、印刷等行业有广泛用途。
(1)工业上可用铜屑、空气与稀硫酸在80℃条件下制备硫酸铜。
①如图1是实验室模拟工业制备硫酸铜的装置,反应的化学方程式为 ,采用水浴加热的优点是 ,多孔球泡的作用为 。

②工业生产时可用纯氧代替空气。这一措施能加快反应速率外,还具有的优点是 。
③实验室用H2O2溶液和MnO2制备O2,反应的化学方程式为 ,在图2中,应选用的发生装置为 (填序号,下同),收集装置为 。
(2)以CuSO4为原料制备碱式碳酸铜[Cu2(OH)2CO3]的过程如图3:
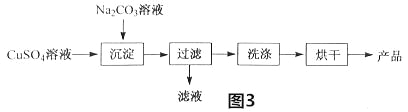
①“沉淀”时的反应为:2CuSO4+2Na2CO3+H2O=Cu2(OH)2CO3↓+2 +CO2↑
②检验沉淀是否洗涤干净选用的试剂是 (填化学式),烘干时产品中出现少量黑色物质,可能的原因为 。
③若所得产品的产率(产率=
 ×100%)偏高,其可能的原因为 (填序号)。
×100%)偏高,其可能的原因为 (填序号)。a.反应物为完全沉淀
b.过滤时滤纸破损
c.Cu2(OH)2CO3未洗涤干净
d.Cu2(OH)2CO3为完全烘干
④“沉淀”时若有少量3Cu(OH)22CuSO4生成,则产品中铜元素的质量分数 。(填“偏大”“不变”或“偏小”)
(3)T℃时加热32.0g硫酸铜,一段时间后得到15.2gCuO和Cu2O的混合物,计算该混合物中CuO的质量(写出计算过程)。
相关试题

