【题目】工业上生产电石(CaC2)制备重要工业原料乙炔(CxHy)流程如下:
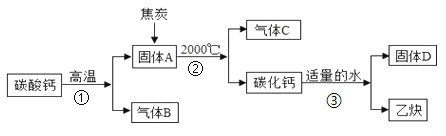
请回答下列问题:
(1)写出碳酸钙高温分解①的化学方程式____________________;B、C组成的元素相同,C有毒,则反应②的化学方程式____________________;根据反应③可推断固体D中一定含有的元素是____________________。
(2)已知:浓硫酸具有强吸水性。一个乙炔分子由4个原子构成。为了测定乙炔的组成,将一定量的乙炔(CxHy)完全燃烧,并将生成的气体缓缓通过下图的__________(选填“甲”或“乙”)装置,再缓缓通过一段时间的N2,缓缓通过一段时间的N2的目的是__________。
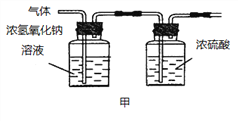
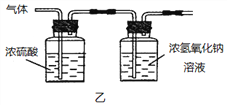
记录实验数据如下:
装置 | 反应前质量 | 反应后质量 |
浓硫酸 | 125.3g | 127.1g |
浓氢氧化钠溶液 | 78.2g | 87.0g |
根据实验数据推断乙炔的化学式(写出推断过程):__________
参考答案:
【答案】 CaCO3![]() CaO+CO2↑ CaO+3C
CaO+CO2↑ CaO+3C![]() CaC2+CO↑ 乙 使生成的气体完全被吸收 乙炔中氢元素的质量:(127.1g-125.3g)×
CaC2+CO↑ 乙 使生成的气体完全被吸收 乙炔中氢元素的质量:(127.1g-125.3g)×![]() =0.2g,乙炔中碳元素的质量:(87.0g-78.2g)×
=0.2g,乙炔中碳元素的质量:(87.0g-78.2g)×![]() =2.4g,根据题意有:
=2.4g,根据题意有:![]() =
=![]() ,解得
,解得![]() =
=![]() C2H2
C2H2
【解析】 (1)碳酸钙高温分解的化学方程式为:CaCO3![]() CaO+CO2↑,B、C组成的元素相同,C有毒,则C是CO,B是CO2。化学反应前后元素种类不变,各种原子个数相等,故反应的化学方程式为:CaO+3C
CaO+CO2↑,B、C组成的元素相同,C有毒,则C是CO,B是CO2。化学反应前后元素种类不变,各种原子个数相等,故反应的化学方程式为:CaO+3C![]() CaC2+CO↑,根据化学反应前后元素种类不变,可推断固体D中一定含有的元素是钙元素和氧元素。(2)将一定量的乙炔完全燃烧,生成的气体全部缓缓通过乙装置,这样可以避免气体通过氢氧化钠溶液时带出的水蒸气,故选乙。再缓缓通过一段时间的N2,目的是使生成的气体完全被吸收。浓硫酸增加的质量是生成水的质量,所以生成水的质量为:127.1g-125.3g=1.8g,浓氢氧化钠溶液增加的质量是生成二氧化碳的质量,所以生成二氧化碳的质量为:87.0g-78.2g=8.8g。1.8g水中氢元素的质量为:1.8g×
CaC2+CO↑,根据化学反应前后元素种类不变,可推断固体D中一定含有的元素是钙元素和氧元素。(2)将一定量的乙炔完全燃烧,生成的气体全部缓缓通过乙装置,这样可以避免气体通过氢氧化钠溶液时带出的水蒸气,故选乙。再缓缓通过一段时间的N2,目的是使生成的气体完全被吸收。浓硫酸增加的质量是生成水的质量,所以生成水的质量为:127.1g-125.3g=1.8g,浓氢氧化钠溶液增加的质量是生成二氧化碳的质量,所以生成二氧化碳的质量为:87.0g-78.2g=8.8g。1.8g水中氢元素的质量为:1.8g×![]() =0.2g,8.8g二氧化碳中碳元素的质量为:8.8g×
=0.2g,8.8g二氧化碳中碳元素的质量为:8.8g×![]() =2.4g,根据题意有:
=2.4g,根据题意有:![]() =
=![]() ,解得
,解得![]() =
=![]() , 因为一个乙炔分子由4个原子构成,所以乙炔的化学式是C2H2
, 因为一个乙炔分子由4个原子构成,所以乙炔的化学式是C2H2
-
科目: 来源: 题型:
查看答案和解析>>【题目】氯化钠和硫酸镁的溶解度曲线与若干温度下的溶解度表如下:
温度/℃
20
30
40
60
80
90
100
溶解度
(g/100GH20)
NaCl
36.0
36.3
36.6
37.3
38.4
39.0
39.8
MgSO4
33.7
38.9
44.5
54.6
55.8
52.9
50.4
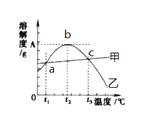
请回答下列问题:
(1)80℃时,硫酸镁的溶解度为__________,溶解度曲线甲所代表的物质是__________。a点对应的温度t1范围是____________________。
(2)t2℃时有含有较多NaCl 的MgSO4溶液,为了得到纯净的MgSO4,可采用的方法__________
(3)40℃时把20g NaCl放入50g水中,形成的溶液中溶质质量分数为__________(精确到0.1%),要使t3℃饱和的MgSO4溶液中溶质质量分数增大,可采用的措施是__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】结合下列装置图回答问题:
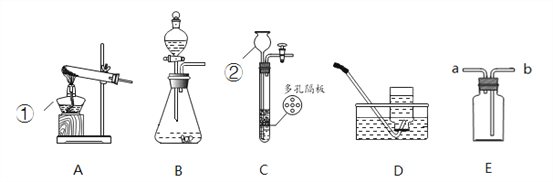
(1)写出仪器名称:①__________,②__________。
(2)用双氧水和二氧化锰制取氧气,可选用装置__________(选填序号)和D组合,化学方程式为__________,二氧化锰的作用是__________。
(3)鸡蛋壳的主要成分是碳酸钙,用鸡蛋壳与稀盐酸反应制CO2可用装置B或装置C,装置C相对于B的优点有__________。
(4)氨气(NH3)是一种无色有刺激性气味,密度比空气小,极易溶于水的气体。实验室用加热固体氯化铵和消石灰的混合物制取氨气(NH3),可选装置__________(选填序号),用E装置收集氨气,气体应从__________(选填“a”或“b”)端通入。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学与生活生产有这密切的联系,请用所学的化学知识回答下列问题。
(1)医疗上常用碘酒来消毒,其溶剂是_____;防毒面具的滤毒罐里盛放了一定量的活性炭,目的是用来除去有毒气体,这是利用活性炭的_____性。
(2)熟石灰、纯碱、天然气、硝酸钾、盐酸、硫酸 六种物质中,可用作改良土壤酸性的物质是_____;可作农作物肥料的是_____,检验该化肥可用_____反应,观察到的现象是_____。
(3)温室效应与大气中的二氧化碳含量增多有关。空气中二氧化碳增多的主要原因是_____;科学研究表明,在一定条件下可通过下述反应,将工业尾气中的CO2转化为一种重要的化工原料X:CO2+4H2
 X+2H2O,则X的化学式为_____。
X+2H2O,则X的化学式为_____。 -
科目: 来源: 题型:
查看答案和解析>>【题目】草木灰的主要成分是碳酸钾。某化学兴趣小组取100g草木灰样品于烧杯中,不断滴入稀盐酸,当烧杯中的残余混合物质量为137.8g时,充分反应。反应过程放出的气体质量与加入盐酸的关系曲线如图表示。(假设草木灰的其他成分不与酸反应)
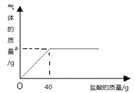
请计算回答:
(1)图中纵坐标上a点数值:a=__________g;放出气体的物质的量为__________ mol。
(2)草木灰样品中碳酸钾的质量分数为________________(要求写出计算过程)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室利用不同的装置制取得到不同的气体。下图是实验室制取气体的各种装置。
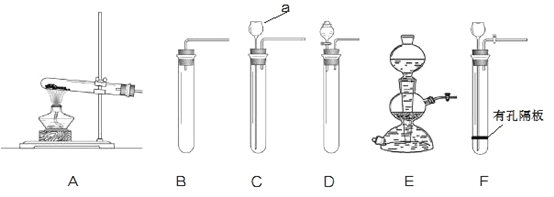
①图中仪器“a”的名称是______。制取气体的装置,放入药品前,均需对装置进 行______检查。
②上述装置按照不同角度可以分为两类,完成表格空白处:
分类依据
装置编号
反应条件
加热
A
不加热
BCDEF
(3)
固体与固体
A
固体与液体
BCDEF
若将“BCDEF”继续分为两类:“BCD”和“EF”两类,“EF”放在一起的理由是:________。
③如果实验室利用氯化铵固体与氢氧化钙固体在加热条件下得到氨气,选用的装置可以是______(选填图中装置编号);实验室利用大理石与稀盐酸反应制取 CO2,若要得到较 多的气体,装置宜选用_______(选填图中装置编号)。
④实验室利用大理石与稀盐酸反应制取 CO2,反应中共消耗了 3.65%的稀盐酸 100g,计算该 盐酸溶液中含 HCl 的物质的量是多少?可以得到 CO2 气体的质量是多少________?(请列式计算)
(7)计算 HCl 的物质的量:_______
(8)计算 CO2 气体的质量:________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】普通电池(锌锰电池)含有多种材料,结构如图。
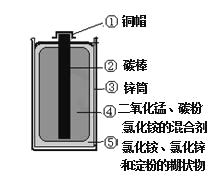
请你根据图示分析:
①图中金属单质有________种,化合物中除有机物外, 无机物还含有_______、_________(填写物质种类名称)。
②写出氯化铵的化学式 _______,在农业上它的 用途是 _________。
③碳棒起导电作用,这是利用了碳棒的______(选填“物理”或“化学”)性质。
④拆解后经处理得到 65g 锌,则所含锌原子个数约为______(用科学记数法表示)。
相关试题

