【题目】我国矿物种类齐全,储量丰富。工业上从从含有金属元素的矿石中提炼金属。其中赤铁矿是炼铁的主要原料。请回答下列问题:
I.铁制品广泛应用于生产、生活中。
(1)下列不属于铁合金的是_____________(选填字母)。
A.Fe(OH)3 B.生铁 C.不锈钢
(2)铁钉生锈,属于_____变化(选填“物理”“化学”):右图是探究铁钉在不同条件下发生生锈的实验,其中铁锈蚀最快的是______(选填字母)。
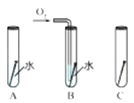
II.赤铁矿(主要成分为Fe2O3)可用于生产催化剂。
(3)在Fe2O3中,氧元素的质量分数为_____________。
(4)赤铁矿经提纯后得到的纯净Fe2O3可用于生产某种工业催化剂(主要成分为FeO和Fe2O3),其反应原理为:2 Fe2O3+C![]() 4FeO+CO2↑。现将焦炭和过量的Fe2O3混合均匀,按上述原理充分反应,右图为固体混合物的质量随反应时间的变化曲线。
4FeO+CO2↑。现将焦炭和过量的Fe2O3混合均匀,按上述原理充分反应,右图为固体混合物的质量随反应时间的变化曲线。
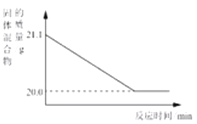
①由图可知:生成CO2气体的质量为_____g。
②计算反应后固体混合物中FeO的质量分数(请根据化学方程式写出完整的计算步骤)。
参考答案:
【答案】(1)A;(2)化学;B;(3)30%;(4)①1.1;②36%。
【解析】(1)合金是在金属加热熔合其他的金属或非金属制得的具有金属特征的物质,故合金属混合物,氢氧化铁出纯净物,不属铁合金,故选A;(2)铁锈的主要成分是氧化铁,即铁生锈生成了新物质属化学变化;铁生锈的条件是铁与水、氧气同时接触。由图可知,铁在B图中最易生锈;(3)Fe2O3中,氧元素的质量分数=![]() 30%;
30%;
(4)根据质量守恒定律化学反应前后物质的总质量不变,故减少的质量即为生成的二氧化碳的质量。生成的二氧化碳的质量=21.1g-20.0g=1.1g;
利用化学方程式,根据氧化亚铁与二氧化碳反应的质量比即可计算出氧化亚铁的质量。
设生成的氧化亚铁的质量为x;
2 Fe2O3+C![]() 4FeO+CO2↑
4FeO+CO2↑
288 44
X 1.1g
![]() x=7.2g
x=7.2g
反应后固体混合物中FeO的质量分数=![]() 36%
36%
答:反应后固体混合物中FeO的质量分数为36% 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙、丙是初中化学常见物质。这些物质之间的转化关系如下图所示。
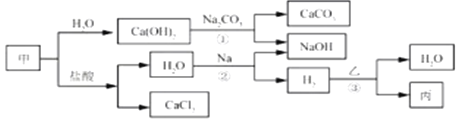
根据以上信息,请回答下列问题。
(1)写出甲的化学式__________。
(2)写出反应①的化学方程式_______________。
(3)写出反应②的化学方程式_______________。该反应属于_____反应(填基本反应类型)。
(4)反应③在一定温度下进行,若乙为Fe2O3,则丙为Fe;若丙为Cu,则乙为_______(填化学式)。
(5)请完成下列表格,证明Fe的金属活动性比Cu的强。
实验方案
实验现象
将铁片浸入_______(填化学式)溶液中
铁片表明析出______固体
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列溶液在空气中敞口放置后,溶液质量因发生化学反应而减小的是
A.石灰水 B.浓硫酸 C.浓盐酸 D.烧碱溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列各物质按照单质、氧化物、混合物的顺序排列的是
A.冰、干冰、食醋 B.氮气、氧气、空气
C.水银、水、矿泉水 D.金、氯酸钾、石油
-
科目: 来源: 题型:
查看答案和解析>>【题目】在电解水的实验中,可以直接观察到的现象是
A.水由氢、氧两种元素组成
B.有氢气和氧气产生,且体积比为2:1
C.在电极上均有气泡产生,两个试管内气体的体积之比约为2:1
D.每个水分子是由两个氢原子和一个氧原子构成的
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于物质的性质和用途说法不正确的是
A. 氧气用于火箭发射,是利用氧气的可燃性
B. 氮气用来保护粮食,是利用氮气常温下化学性质稳定
C. 稀有气体充入霓虹灯,是利用稀有气体通电能发出不同颜色的光
D. 二氧化碳用于灭火,是利用它的物理性质和化学性质
-
科目: 来源: 题型:
查看答案和解析>>【题目】某有机物M在足量氧气中充分燃烧的化学方程式如下:2M+13O2→8CO2+10H2O.则M的化学式为
A.C4H10 B.CH4 C.CH4O D.C2H4O2
相关试题

