【题目】某班同学用氧化钠溶液和稀盐酸进行中和反应实验。

(1)甲同学实验操作如图:在烧杯中加入约5mL氢氧化钠溶液,滴入几滴无色酚酞溶液,此时溶液呈_____色.再用滴管滴入一定量的稀盐酸,再用玻璃棒搅拌,发现溶液为无色,于是甲同学得出两者恰好中和的结论,反应的化学方程式为_____________.
(2)乙同学对甲同学的结论提出了质凝,并对反应后溶液中的溶质成分进行探究.
【实验探究】
反应后溶液中的溶质是什么?
猜想一:只有NaCl
猜想二:NaCl和HCl
猜想三:NaCl和NaOH
以上猜想中,你觉得不合理的是 .
为了验证另外两种猜想,乙同学设计如下实验方案:
实验操作 | 实验现象 | 实验结论 |
取少量反应后的溶液于试管中滴入Na2CO3溶液 | _______________ | 猜想二成立 |
【反思交流】
实验结束后,废液处理方法正确的是 (填序号).
A.倒入下水道 B.倒入废液缸 C.带出实验室.
参考答案:
【答案】(1)红色,NaOH+ HCl= NaCl+ H2O
(2)猜想三,实验现象:有气泡冒出 B
【解析】
试题分析:氢氧化钠显示碱性能够使得无色的酚酞变为红色,当滴入盐酸后,二者会发生反应,反应为:NaOH+ HCl= NaCl+ H2O;反应后的溶质不能为猜想三,因为如果还有氢氧化钠,则溶液还是碱性,酚酞不可能变为无色,取少量反应后的溶液于试管中滴入Na2CO3溶液,如果酉气泡冒出,说明猜想二成立,因为盐酸会和碳酸钠反应产生二氧化碳气体,实验结束后,废液处理原则是倒入指定的废物桶里,不能随便乱倒。
-
科目: 来源: 题型:
查看答案和解析>>【题目】核电荷数为1~18的元素的原子结构示意图等信息如下,请回答下列问题
ⅠA
0
第一周期
1 H
氢
1.008
2 He
氦
4.003
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
第二周期
3 Li
锂
6.941
4 Be
铍
9.012
5 B
硼
10.81
6 C
碳
12.01
7 N
氮
14.01
8 O
氧
16.00
9 F
氟
19.00
10 Ne
氖
20.18
第三周期
11 Na
钠
22.99
12 Mg
镁
24.31
13 Al
铝
26.98
14 Si
硅
28.09
15 P
磷
30.97
16 S
硫
32.06
17 Cl
氯
35.45
18 Ar氩
39.95
(1)元素周期表中位于第三周期、第IIIA族的元素是________(填名词),该元素的原子在化学反应中容易_______(填“得”或“失”)
(2)不同种元素最本质的区别是__________。
A.质子数不同 B.最外层电子数不同
C.中子数不同 D.相对原子质量不同
(3)右图为某粒子结构示意图,当x﹣y=8时,该粒子符号为____________。

-
科目: 来源: 题型:
查看答案和解析>>【题目】卤水中含有MgCl2、KCl和MgSO4等物质,下图是它们的溶解度曲线。完成下列填空。
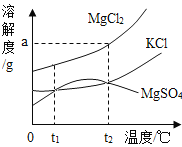
(1)在t1℃时,向100 g水中加入150 g MgCl2,形成 (填“饱和”或“不饱和”)溶液,将其温度升高到t2℃时,此时溶液中溶质的质量分数为 。
(2)t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是 。将t2℃时MgCl2、KCl和MgSO4三种物质的饱和溶液降温至t1℃时,可能会析出的晶体有 (填字母序号)。
A.MgCl2和KCl
B.只有MgSO4
C.MgCl2、KCl和MgSO4
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质之间不能发生化学反应的是
A.石灰水与稀盐酸 B.铜与硝酸银溶液
C.银与稀硫酸 D.二氧化碳与水
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是a、b、c三种物质的溶解度曲线,下列分析不正确的是
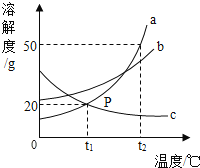
A. t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>c
B. t2℃时,将50ga物质(不含结晶水)放入100g水中充分溶解得到a的饱和溶液
C. 将t2℃时,a、b、c三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系是b>a=c
D. 将c的饱和溶液变为不饱和溶液,可采用降温的方法
-
科目: 来源: 题型:
查看答案和解析>>【题目】“微观﹣宏观﹣符号”三重表征是化学独特的表示物质及其变化的方法.请结合图示完成下列问题:

(1)图1中,“Cu”表示多种信息,如表示铜元素、金属铜单质,还能表示______________;
(2)从微粒的角度说明图2反应的实质是____________________;
(3)为减少温室气体排放,人们积极寻找不含碳元素的燃料.经研究发现NH3燃烧的产物没有污染.且释放大量能量,有一定应用前景.其反应的微观示意图如图3:

该反应的化学方程式为________________,其基本反应类型属于______________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】锂电池是一种新型的高能电池,质量轻、容量大,颇受手机、电脑等用户的青睐。某种锂电池的总反应式可表示为:Li十MnO2═LiMnO2下列说法错误的是
A.该反应前后锂元素的化合价发生了变化
B.MnO2中Mn的化合价为+4价
C.LiMnO2属于氧化物
D.该反应属于化合反应
相关试题

