【题目】为测定某纯碱(Na2CO3)样品中(含有少量的氯化钠杂质)碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(产生的气体全部逸出)。产生气体的质量与滴入稀盐酸的质量关系如图所示,
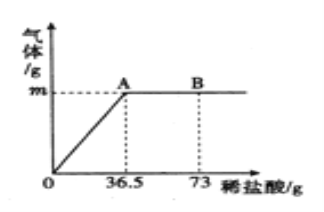
(1)A点产生气体的质量m为_______, 此时所得溶液的溶质质量为 ______。
(2)B点时,烧杯内溶液中粒子有__________________________。(写粒子符号)
参考答案:
【答案】 2.2 6.55g Na+、Cl—、H+、H2O
【解析】1)据质量守恒定律可知反应前后物质的总质量不变,故A点产生气体的质量m为6g+36.5g-40.3g=2.2g, 此时所得溶液的溶质为碳酸钠和盐酸反应生成的氯化钠,设生成氯化钠的质量为x,样品中碳酸钠的质量为y
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
106 117 44
y x 2.2g
![]() x=5.85g
x=5.85g
![]() y=5.3g A点时所得溶液的溶质质量为6g-5.3g+5.85g=6.55g。
y=5.3g A点时所得溶液的溶质质量为6g-5.3g+5.85g=6.55g。
(2)A点时恰好完全反应,溶质只有氯化钠,B点时,盐酸过量,烧杯内溶液中溶质是氯化钠和氯化氢,粒子有Na+、Cl—、H+、H2O。
-
科目: 来源: 题型:
查看答案和解析>>【题目】看图回答下列问题
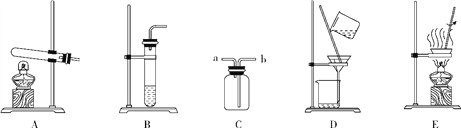
(1)实验室用装置A制取氧气的化学方程式为_______________________。
(2)用装置C排空气收集二氧化碳,验满时,燃着木条应放在______ (填“a”或 “b”)端。
(3)实验室制取二氧化碳后,若从所得液中回收CaCl2固体(CaCl2可溶),应进行的操作是___________。(填写装置编号)
-
科目: 来源: 题型:
查看答案和解析>>【题目】我们常用实验探究的方法来研究常见物质的组成,如图
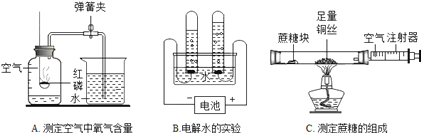
(1)实验A发生反应得化学方程式为_________。
(2)生活中,我们偶尔会看见蔗糖在锅里加热时间过长会变成黑色。那么蔗糖是由哪些元素组成的呢?某同学用C装置进行实验(夹持和支撑装置略去)来测定蔗糖的组成。
小资料:
Ⅰ 铜丝在加热条件下能与氧气发生反应生成黑色固体氧化铜。
Ⅱ 蔗糖在空气中燃烧生成二氧化碳和水。
实验步骤:先用酒精灯在玻璃管铜丝处加热,同时反复推拉注射器活塞,充分反应后,再将酒精灯移至蔗糖处进行加热。观察到玻璃管中蔗糖处生成黑色的固体,内壁有水珠出现。
实验结论:蔗糖中一定含有_____元素(写元素符号)。
实验分析:上述实验过程中,先对铜丝进行加热,并同时反复推拉注射器活塞的作用是______。
实验原理:与_____(填A或B)实验相同。
-
科目: 来源: 题型:
查看答案和解析>>【题目】学习酸碱盐知识后,同学们知道碳酸钠溶液与氢氧化钙溶液能发生反应,可观察到溶液变浑浊。甲组同学进行右图所示的实验,却未观察到预期现象。

【提出问题】未观察到浑浊的原因是什么?
【猜想和假设】
①与氢氧化钙溶液的浓度有关。若使用更大浓度的氢氧化钙溶液,会迅速产生浑浊。
②与碳酸钠溶液的浓度有关。若使用更大浓度的碳酸钠溶液,会迅速产生浑浊。经讨论,同学们认为猜想①不合理,其理由是 。
【进行实验】乙组同学针对猜想②进行实验。
实验目的
实验操作
实验现象
探究猜想②
取4支试管,向其中分别加入
碳酸钠溶液浓度/%
是否浑浊
10
不浑浊
5
不浑浊
1
浑浊
0.5
浑浊
【解释与结论】
(1)补全上述实验操作:取4支试管,向其中分别加入 。
(2)氢氧化钙溶液与碳酸钠溶液混合出现浑浊的化学方程式是 。
(3)乙组实验证明:猜想②不成立,碳酸钠溶液浓度在0.5~10%的范围内,能否出现浑浊与碳酸钠溶液的浓度有关,其关系是 。
【实验反思】
(1)丙组同学对乙组所做实验中未出现浑浊的原因进行探究。设计了多组实验,其中部分同学的实验过程及结果如下:

丙组同学的实验目的是 。
(2)依据乙、丙两组的实验探究,丁组同学仍使用甲组的仪器和药品对甲组实验进行了改进,当滴入几滴某溶液后,溶液迅速变浑浊。其实验操作是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了如下探究实验。请你与他们一起完成以下探究活动:
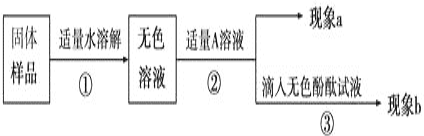
【对固体猜想】
猜想Ⅰ:全部是NaOH;猜想Ⅱ:全部是Na2CO3;猜想Ⅲ:_____________。
【实验和推断】
(1)若现象a为有气泡产生,则加入的A溶液是_____________,说明氢氧化钠已经变质,有气泡产生的反应的化学方程式___________________________________。
(2)若A是Ca(OH)2溶液,现象a有白色沉淀,现象b为无色酚酞试液变红色,则白色沉淀为___________(填化学式),该实验________(填“能”或“不能”)说明样品中有NaOH。
(3)若A是CaCl2溶液,当实验现象a为____________________,现象b为______________,则猜想Ⅱ成立。(4)若用PH试纸测定操作①所得无色溶液的PH,操作方法为____________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下面是几种实验室制取气体的发生装置(A、B)和收集装置(C、D、E),洗气装置(F)。
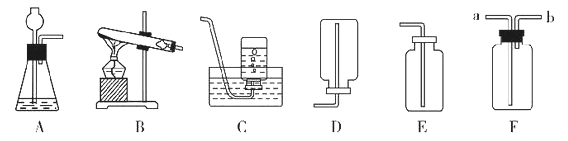
(1)实验室制取并收集二氧化碳时应选用的仪器装置________(填字母标号);检验二氧化碳是否集满的方法是:___________。
(2)上述装置中的A和C组合后,可以用来制取并收集氧气,写出实验室制取该气体的化学方程式:___。(3)如果用F装置干燥氧气,则F装置中装入浓硫酸后,氧气应从_______(填“a”或“b”)进入F中。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学与生产生活、社会发展息息相关,请回答。
(1)家用净水器中使用活性炭是利用了它的______________性。(2)铁粉是常见的食品保鲜剂,其原因是 ________________________________。
(3)打开可乐瓶有大量气泡逸出,说明气体溶解度___________________________。
(4)使用天然气热水器时要保证通风良好,避免生成有剧毒的_________(填化学式)。
(5)为提高煤的利用率,可将碳与水蒸气反应得到两种可燃性气体,其微观示意图如下:
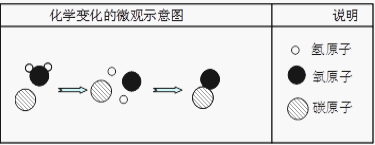
Ⅰ.根据质量守恒定律判断,上述微观示意图中缺少的粒子是____________填序号)。

Ⅱ.该反应中的最小粒子是___________________(填粒子名称)。
(6)经研究发现氨气(NH3)燃烧的产物没有污染,且释放大量能量,有一定应用前景。氨气燃烧生成水和另一种气体单质,该气体占空气的体积分数约为78%,氨气燃烧反应的化学方程式__________。(7)近年来利川市各乡镇政府大力支持农村兴建沼气池,沼气的主要成分是甲烷,它是最简单的有机化合物;甲烷宏观上由________________组成;微观上它由____________构成。
相关试题

